PH ne descend pas
+6
superloupiot
giorgino13
laurent 59
Dark Moule
enjy14
axeon2007
10 participants
Page 1 sur 3 • 1, 2, 3 

 axeon2007Membre : Occasionnel
axeon2007Membre : Occasionnel
 Nombre de messages : 117
Nombre de messages : 117
Localisation : Waterloo
Emploi : finances
Date d'inscription : 17/12/2010
 PH ne descend pas
PH ne descend pas
Lun 26 Jan 2015 - 21:02
Salut. Tout est dans le titre!
Je ne comprends pas. J'ai un KH de 5°. J'ai règlé le PH sur mon controlleur sur 6.9 . La sonde est nouvelle et je l'ai testée en solution PH4... donc ok.
Le controleur injecte donc du co2 non-stop... et le PH ne descend pas en dessous de 7.00.
De plus, je n'arrive pas à atteindre une valeur de 20mg/l de co2. Comme si j'avais un KH de 15
Qu'en pensez-vous ? Etrange non?
Je ne comprends pas. J'ai un KH de 5°. J'ai règlé le PH sur mon controlleur sur 6.9 . La sonde est nouvelle et je l'ai testée en solution PH4... donc ok.
Le controleur injecte donc du co2 non-stop... et le PH ne descend pas en dessous de 7.00.
De plus, je n'arrive pas à atteindre une valeur de 20mg/l de co2. Comme si j'avais un KH de 15
Qu'en pensez-vous ? Etrange non?
 enjy14Membre : Habitué
enjy14Membre : Habitué
 Nombre de messages : 596
Nombre de messages : 596
Age : 25
Localisation : Thorigné-Fouillard
Emploi : Lycée
Date d'inscription : 01/01/2014
 Re: PH ne descend pas
Re: PH ne descend pas
Lun 26 Jan 2015 - 21:05
Salut, le Kh doit être inferieur a 4 
 Dark MouleMembre : Occasionnel
Dark MouleMembre : Occasionnel
 Nombre de messages : 120
Nombre de messages : 120
Age : 37
Localisation : Yvelines
Emploi : Président de la République des Météors
Date d'inscription : 06/09/2009
 Re: PH ne descend pas
Re: PH ne descend pas
Mar 27 Jan 2015 - 13:49
Test des fruits d'aulnes environ: 2 pour 20 llitres sachant qu'il faut en ajouter au fur et à mesure sur Plusieurs jours tout en contrôlant le ph
 laurent 59Membre : Habitué
laurent 59Membre : Habitué
 Nombre de messages : 874
Nombre de messages : 874
Age : 39
Localisation : merville
Date d'inscription : 10/01/2012
 Re: PH ne descend pas
Re: PH ne descend pas
Mar 27 Jan 2015 - 14:46
salut
pas de fruit d'aulne avec co2 je pense , comme dit plus haut descend le kh ,regarde le tableau de correspondance dans le lien .
https://www.forumaquario.org/t30200-la-fertilisation-d-un-bac-plante#356040
ne change pas ton débit de co2 pour l'instant et fait des changements d'eau osmosée pour descendre le kh.
plus le kh est élevé plus il faut injecter de co2 pour voir les effets ,donc plus de dépenses.
tu as des poissons dans ton bacs?
pas de fruit d'aulne avec co2 je pense , comme dit plus haut descend le kh ,regarde le tableau de correspondance dans le lien .
https://www.forumaquario.org/t30200-la-fertilisation-d-un-bac-plante#356040
ne change pas ton débit de co2 pour l'instant et fait des changements d'eau osmosée pour descendre le kh.
plus le kh est élevé plus il faut injecter de co2 pour voir les effets ,donc plus de dépenses.
tu as des poissons dans ton bacs?
 axeon2007Membre : Occasionnel
axeon2007Membre : Occasionnel
 Nombre de messages : 117
Nombre de messages : 117
Localisation : Waterloo
Emploi : finances
Date d'inscription : 17/12/2010
 Re: PH ne descend pas
Re: PH ne descend pas
Mar 27 Jan 2015 - 17:23
OK je vais rajouter de l'eau osmosee,histoire de faire descendre le kh à 4. J' ai quand même du mal à croire que de passer à un k de 5 à 4 va résoudre mes problèmes :##10:
 giorgino13Membre : Régulier
giorgino13Membre : Régulier
 Nombre de messages : 283
Nombre de messages : 283
Localisation : 92
Emploi : informaticien
Date d'inscription : 17/02/2014
 Re: PH ne descend pas
Re: PH ne descend pas
Mar 27 Jan 2015 - 17:38
Moi je te dirai de rajouter de la tourbe dans ton filtre. C'est ce que j'ai fait pour pouvoir baisser mon PH. Mon KH etait de 5 aussi.
 laurent 59Membre : Habitué
laurent 59Membre : Habitué
 Nombre de messages : 874
Nombre de messages : 874
Age : 39
Localisation : merville
Date d'inscription : 10/01/2012
 Re: PH ne descend pas
Re: PH ne descend pas
Mar 27 Jan 2015 - 19:02
salut
le kh influence le PH et le stabilise ,donc plus il est élevé ,plus le ph sera difficile à modifier.
en fait le KH,le PH et taux de co2 dissous sont liés.
tu as regardé le tableau dans le lien?
avec un kh de 5 et un ph de 7 tu as environ 15 mg/l de co2.
sans changer le taux de co2 et en baissant le kh tu auras un ph de 6.9 avec un kh de 4 , et + ou - 6.8 avec un kh de 3.
le kh influence le PH et le stabilise ,donc plus il est élevé ,plus le ph sera difficile à modifier.
en fait le KH,le PH et taux de co2 dissous sont liés.
tu as regardé le tableau dans le lien?
avec un kh de 5 et un ph de 7 tu as environ 15 mg/l de co2.
sans changer le taux de co2 et en baissant le kh tu auras un ph de 6.9 avec un kh de 4 , et + ou - 6.8 avec un kh de 3.
 axeon2007Membre : Occasionnel
axeon2007Membre : Occasionnel
 Nombre de messages : 117
Nombre de messages : 117
Localisation : Waterloo
Emploi : finances
Date d'inscription : 17/12/2010
 Re: PH ne descend pas
Re: PH ne descend pas
Mar 27 Jan 2015 - 22:32
Donc,si je comprend, impossible d' arriver à une concentration optimale de co2 pour les plantes si ph>6.8, donc kh > 4? AM I right ?
 laurent 59Membre : Habitué
laurent 59Membre : Habitué
 Nombre de messages : 874
Nombre de messages : 874
Age : 39
Localisation : merville
Date d'inscription : 10/01/2012
 Re: PH ne descend pas
Re: PH ne descend pas
Mer 28 Jan 2015 - 2:10
Salut
Impossible je ne sais pas mais si tu augmentes encore le débit de co2 tu y arriveras sûrement .mais ça va coûter cher en co2.
Descend le kh à 4 et tu verras si c'est bon ,si non baisse jusque 3.
Impossible je ne sais pas mais si tu augmentes encore le débit de co2 tu y arriveras sûrement .mais ça va coûter cher en co2.
Descend le kh à 4 et tu verras si c'est bon ,si non baisse jusque 3.
 axeon2007Membre : Occasionnel
axeon2007Membre : Occasionnel
 Nombre de messages : 117
Nombre de messages : 117
Localisation : Waterloo
Emploi : finances
Date d'inscription : 17/12/2010
 Re: PH ne descend pas
Re: PH ne descend pas
Mer 28 Jan 2015 - 7:45
Merci à toi...Pour bien comprendre: plus le kh est élevé, au moins le co2 va se dissoudre. Juste? Ou... il va se dissoudre, mais sans pour autant modifier le ph?
Le taux optimal de gaz carbonique est bien 20 mg par litre?
Supermerci pour toi aide.
Le taux optimal de gaz carbonique est bien 20 mg par litre?
Supermerci pour toi aide.
 laurent 59Membre : Habitué
laurent 59Membre : Habitué
 Nombre de messages : 874
Nombre de messages : 874
Age : 39
Localisation : merville
Date d'inscription : 10/01/2012
 Re: PH ne descend pas
Re: PH ne descend pas
Mer 28 Jan 2015 - 8:02
salut
le co2 va se dissoudre mais son effet sera moindre.
pour le taux de 20mg/l oui c'est bon .même si il existe une petite fourchette .
le co2 va se dissoudre mais son effet sera moindre.
pour le taux de 20mg/l oui c'est bon .même si il existe une petite fourchette .
 superloupiotMembre : Habitué
superloupiotMembre : Habitué
 Nombre de messages : 835
Nombre de messages : 835
Localisation : Belgique
Emploi : Electronicien
Date d'inscription : 08/09/2013
 Re: PH ne descend pas
Re: PH ne descend pas
Jeu 29 Jan 2015 - 13:19
Oui, mais à combien de bulles par minute?axeon2007 a écrit:
Le controleur injecte donc du co2 non-stop... et le PH ne descend pas en dessous de 7.00.
Il est probable que tu ne laches pas assez de bulles par minute pour atteindre la concentration en CO2 qui te permettrait d'atteindre la valeur de pH que tu cibles.
De plus, la mesure du KH n'est pas précise non plus.
Ton test te donne un KH de 5, mais en réalité il est peut-être de 6.
D'autre part, la concentration en CO2 que tu vas atteindre dans ton aquarium ne dépend pas du KH.
Elle dépend seulement de la quantité de CO2 que tu envoies dans l'aquarium et de l'efficacité de ton diffuseur.
Il n'est pas plus difficile d'obtenir une concentration de 20mg/l de CO2 dans ton aquarium avec un KH de 0 quavec un KH de 15.
Le seul paramètre qui va varier avec ton KH sera la pH.
 axeon2007Membre : Occasionnel
axeon2007Membre : Occasionnel
 Nombre de messages : 117
Nombre de messages : 117
Localisation : Waterloo
Emploi : finances
Date d'inscription : 17/12/2010
 Re: PH ne descend pas
Re: PH ne descend pas
Jeu 29 Jan 2015 - 15:00
Merci pour ta réponse. Après avoir beaucoup réfléchi. Je me suis rendu compte que j'ai peut-être 'dégazé' mon bac avec là canne de rejet du filtre. J'ai enlevé le coude hier soir...et ce matin le ph était redescendu. Reste à confirmer après un journée de photosynthèse
 Ha-DêAquariophile averti
Ha-DêAquariophile averti
 Nombre de messages : 4176
Nombre de messages : 4176
Age : 55
Localisation : Paris
Emploi : DG
Date d'inscription : 09/04/2012
 Re: PH ne descend pas
Re: PH ne descend pas
Jeu 29 Jan 2015 - 17:11
axeon2007 a écrit:Merci pour ta réponse. Après avoir beaucoup réfléchi. Je me suis rendu compte que j'ai peut-être 'dégazé' mon bac avec là canne de rejet du filtre. J'ai enlevé le coude hier soir...et ce matin le ph était redescendu. Reste à confirmer après un journée de photosynthèse
A mon avis c'était bien ça le problème.
A KH 5, ça descend encore assez bien, sauf si évidemment si le débit de CO2 était très faible et/ou la consommation par les plantes très importante.
_________________
Mes bacs : 240l planté/64l "Walstad"/Nano 20l/Nano 30l/Nano Reef 80l
"Walstad" = sans filtre, sans changements d'eau, substrat : terre + gravier



 Ha-DêAquariophile averti
Ha-DêAquariophile averti
 Nombre de messages : 4176
Nombre de messages : 4176
Age : 55
Localisation : Paris
Emploi : DG
Date d'inscription : 09/04/2012
 Re: PH ne descend pas
Re: PH ne descend pas
Jeu 29 Jan 2015 - 17:44
superloupiot a écrit:(...)
D'autre part, la concentration en CO2 que tu vas atteindre dans ton aquarium ne dépend pas du KH.
Elle dépend seulement de la quantité de CO2 que tu envoies dans l'aquarium et de l'efficacité de ton diffuseur.
Il n'est pas plus difficile d'obtenir une concentration de 20mg/l de CO2 dans ton aquarium avec un KH de 0 quavec un KH de 15.
Le seul paramètre qui va varier avec ton KH sera la pH.
Je partage ce que tu as dit avant superloupiot, sauf sur cette analyse que je ne trouve pas très claire.
Quand on compare les choses c'est à KH égal.
Donc pour un débit de CO2 donné avec les mêmes conditions (diffuseur), la concentration de CO2 obtenue va dépendre du KH. Plus il est élevé et moins on arrivera à dissoudre de CO2.
Pour obtenir la même concentration de 20 mg/l de CO2, il faut en injecter beaucoup beaucoup plus à KH 15 qu'à KH plus faible et a fortiori nul.
En conclusion à KH fixe (on ne s'amuse pas ajouter des sels en même temps que le CO2...), en injectant du CO2, ce dernier va se dissoudre et le pH va baisser.
Encore une fois, il faut savoir lire les tableaux de KH/pH/taux de CO2.
Par exemple si on regarde à pH = 6,0.
Le taux de CO2 dissous à KH 15 est énorme par rapport à celui de KH 0.
Comment interpréter ce résultat?
En fait pour dissoudre le CO2 à KH 15, il faut en injecter des quantités importantes (débits importants) et si on arrive à atteindre un PH 6,0, c'est que les quantités étaient réellement énormes et dans ce cas, le taux de CO2 dissous est important... mais à quel prix? (en consommation de CO2 gazeux)
_________________
Mes bacs : 240l planté/64l "Walstad"/Nano 20l/Nano 30l/Nano Reef 80l
"Walstad" = sans filtre, sans changements d'eau, substrat : terre + gravier



 Cory29Membre : Accro
Cory29Membre : Accro
 Nombre de messages : 2408
Nombre de messages : 2408
Localisation : Finistère
Emploi : Retraité contrôle des populations (tueur à gages)
Date d'inscription : 18/05/2014
 Re: PH ne descend pas
Re: PH ne descend pas
Jeu 29 Jan 2015 - 17:59
Balle au centre !
Service : superloupiot :##06:
Service : superloupiot :##06:
 superloupiotMembre : Habitué
superloupiotMembre : Habitué
 Nombre de messages : 835
Nombre de messages : 835
Localisation : Belgique
Emploi : Electronicien
Date d'inscription : 08/09/2013
 Re: PH ne descend pas
Re: PH ne descend pas
Jeu 29 Jan 2015 - 18:38
Salut Ha-Dê,
Je ne suis pas du tout d'accord avec toi sur ce point.
Pour moi, la même quantité de CO2 que tu injectes se dissout dans l'eau quelque soit le KH.
Si tu injectes x bulles par minutes de CO2 dans une eau à KH=1 et que tu obtiens une concentration de 20mg/l de CO2 dissout dans l'eau, en remontant ton KH à 15, tu obtiendras la même concentration de CO2 dissout.
Dans les deux cas, les plantes auront à leur disposition 20 mg/l de CO2 pour pousser.
Par contre, avec un KH de 1, le pH sera de 6.2 et avec un KH de 15, il sera de 7.4
Pour moi, le tableau montre juste l'effet du pouvoir tampon du KH. Plus le KH est élevé, et plus le pH sera élevé en présence d'une même quantité de substance acide. Tu obtiendrais exactement le même effet de pH plus haut si KH plus élevé avec la tourbe par exemple.
Note qu'en lisant le tableau, on peut remarquer que le pH diminue de la même quantité à variation de CO2 identique quelque soit le KH.
Un exemple à partir du tableau:
J'ai une eau de départ avec 3mg/l de CO2.
A KH=1, le pH=7
A KH=5, le pH=7.7
A KH=10, le pH=8
Je monte maintenant la concentration de CO2 à 24mg/l
A KH=1, le pH=6.1
A KH=5, le pH=6.8
A KH=10, le pH=7.1
Dans tout les cas, la variation de pH sera de 0.9.
Donc, il est faux de dire (je l'ai déjà souvent entendu) que le pH varie moins lorsque le KH est élevé.
Le pH varie exactement de la même façon, mais sa valeur absolue est simplement plus élevée à KH élevé.
Et comme ici on a à faire à une discussion sur les plantes, il vaut mieux diminuer le KH car trop de KH indique trop de calcium ce qui freine la croissance des plantes car les empêches d'absorber le CO2.
Maintenant, un KH de 5 est plus qu'acceptable pour les plantes, mais si tu veux un pH plus bas et que tu veux réguler cela avec du CO2, alors il vaut mieux le descendre au alentour de 3 ou 4, tout dépend du pH et de la concentration en CO2 que tu cibles.
Et concernant cette histoire de ne pas mélanger l'eau ou ne pas secouer la surface pour ne pas dégazer, c'est tout à fait vrai mais il ne faut pour moi pas voir le problème dans ce sens là. Les remous en surface sont bénéfiques pour l'oxygénation et éviter le film bactérien en surface. De même, le courant dans l'eau est bénéfique pour entraîner les déchets. Plutôt que de réduire le fonctionnement de l'aquarium, il vaut mieux augmenter un peux l'injection de CO2 pour compenser le dégazage.
Je ne suis pas du tout d'accord avec toi sur ce point.
Pour moi, la même quantité de CO2 que tu injectes se dissout dans l'eau quelque soit le KH.
Si tu injectes x bulles par minutes de CO2 dans une eau à KH=1 et que tu obtiens une concentration de 20mg/l de CO2 dissout dans l'eau, en remontant ton KH à 15, tu obtiendras la même concentration de CO2 dissout.
Dans les deux cas, les plantes auront à leur disposition 20 mg/l de CO2 pour pousser.
Par contre, avec un KH de 1, le pH sera de 6.2 et avec un KH de 15, il sera de 7.4
Pour moi, le tableau montre juste l'effet du pouvoir tampon du KH. Plus le KH est élevé, et plus le pH sera élevé en présence d'une même quantité de substance acide. Tu obtiendrais exactement le même effet de pH plus haut si KH plus élevé avec la tourbe par exemple.
Note qu'en lisant le tableau, on peut remarquer que le pH diminue de la même quantité à variation de CO2 identique quelque soit le KH.
Un exemple à partir du tableau:
J'ai une eau de départ avec 3mg/l de CO2.
A KH=1, le pH=7
A KH=5, le pH=7.7
A KH=10, le pH=8
Je monte maintenant la concentration de CO2 à 24mg/l
A KH=1, le pH=6.1
A KH=5, le pH=6.8
A KH=10, le pH=7.1
Dans tout les cas, la variation de pH sera de 0.9.
Donc, il est faux de dire (je l'ai déjà souvent entendu) que le pH varie moins lorsque le KH est élevé.
Le pH varie exactement de la même façon, mais sa valeur absolue est simplement plus élevée à KH élevé.
Et comme ici on a à faire à une discussion sur les plantes, il vaut mieux diminuer le KH car trop de KH indique trop de calcium ce qui freine la croissance des plantes car les empêches d'absorber le CO2.
Maintenant, un KH de 5 est plus qu'acceptable pour les plantes, mais si tu veux un pH plus bas et que tu veux réguler cela avec du CO2, alors il vaut mieux le descendre au alentour de 3 ou 4, tout dépend du pH et de la concentration en CO2 que tu cibles.
Et concernant cette histoire de ne pas mélanger l'eau ou ne pas secouer la surface pour ne pas dégazer, c'est tout à fait vrai mais il ne faut pour moi pas voir le problème dans ce sens là. Les remous en surface sont bénéfiques pour l'oxygénation et éviter le film bactérien en surface. De même, le courant dans l'eau est bénéfique pour entraîner les déchets. Plutôt que de réduire le fonctionnement de l'aquarium, il vaut mieux augmenter un peux l'injection de CO2 pour compenser le dégazage.
 Ha-DêAquariophile averti
Ha-DêAquariophile averti
 Nombre de messages : 4176
Nombre de messages : 4176
Age : 55
Localisation : Paris
Emploi : DG
Date d'inscription : 09/04/2012
 Re: PH ne descend pas
Re: PH ne descend pas
Jeu 29 Jan 2015 - 20:24
Cory29 a écrit:Balle au centre !
Service : superloupiot :##06:
Merci Cory29!
Avec la dernière réponse de superloupiot ci-dessus, la balle est donc de mon côté.
Il faut que je prenne un peu le temps de répondre suite à cette longue affirmation.
Il va falloir revenir aux solutions aqueuses et donc quelques notions théoriques seront nécessaires.
Car évidemment je ne suis pas d'accord avec ton raisonnement superloupiot.
Ce qui me fait peur, c'est que tu fais des déductions logiques avec un côté déductif/mathématiques à partir d'un tableau en faisant totalement abstraction de la chimie qui t'échappe visiblement (et ne se voit pas dans le tableau).
Par ailleurs tu alternes des affirmations justes et fausses pour soutenir ton raisonnement et en arriver à des conclusions (fausses) non démontrées par tes "déductions".
Il faut donc vraiment que je prenne le temps de tout éclaircir mais en attendant voici mes commentaires :
superloupiot a écrit:(...)
Pour moi, la même quantité de CO2 que tu injectes se dissout dans l'eau quelque soit le KH.
>> Incorrect.
Si tu injectes x bulles par minutes de CO2 dans une eau à KH=1 et que tu obtiens une concentration de 20mg/l de CO2 dissout dans l'eau, en remontant ton KH à 15, tu obtiendras la même concentration de CO2 dissout.
>> Incorrect.
Le taux de CO2 ne reste pas le même.
Dans les deux cas, les plantes auront à leur disposition 20 mg/l de CO2 pour pousser.
>> Incorrect.
Par contre, avec un KH de 1, le pH sera de 6.2 et avec un KH de 15, il sera de 7.4
>> OK pour un taux de CO2 égal ce qui n'est pas le cas.
Pour moi, le tableau montre juste l'effet du pouvoir tampon du KH. Plus le KH est élevé, et plus le pH sera élevé en présence d'une même quantité de substance acide. Tu obtiendrais exactement le même effet de pH plus haut si KH plus élevé avec la tourbe par exemple.
>> Correct. Mais je ne vois pas trop ce que vient faire cette affirmation ici.
Note qu'en lisant le tableau, on peut remarquer que le pH diminue de la même quantité à variation de CO2 identique quelque soit le KH.
>> Incorrect.
Un exemple à partir du tableau:
J'ai une eau de départ avec 3mg/l de CO2.
A KH=1, le pH=7
A KH=5, le pH=7.7
A KH=10, le pH=8
Je monte maintenant la concentration de CO2 à 24mg/l
A KH=1, le pH=6.1
A KH=5, le pH=6.8
A KH=10, le pH=7.1
Dans tout les cas, la variation de pH sera de 0.9.
Donc, il est faux de dire (je l'ai déjà souvent entendu) que le pH varie moins lorsque le KH est élevé.
>> Incorrect.
Le pH varie exactement de la même façon, mais sa valeur absolue est simplement plus élevée à KH élevé.
>> Je ne sais plus quoi dire car même l'usage de la notion mathématique de valeur absolue est incorrecte...
(...)
A suivre...
_________________
Mes bacs : 240l planté/64l "Walstad"/Nano 20l/Nano 30l/Nano Reef 80l
"Walstad" = sans filtre, sans changements d'eau, substrat : terre + gravier



 superloupiotMembre : Habitué
superloupiotMembre : Habitué
 Nombre de messages : 835
Nombre de messages : 835
Localisation : Belgique
Emploi : Electronicien
Date d'inscription : 08/09/2013
 Re: PH ne descend pas
Re: PH ne descend pas
Jeu 29 Jan 2015 - 20:41
A mon avis, on va difficilement tomber d'accord sur ce coup là :##06:
 Ha-DêAquariophile averti
Ha-DêAquariophile averti
 Nombre de messages : 4176
Nombre de messages : 4176
Age : 55
Localisation : Paris
Emploi : DG
Date d'inscription : 09/04/2012
 Re: PH ne descend pas
Re: PH ne descend pas
Jeu 29 Jan 2015 - 23:05
superloupiot a écrit:A mon avis, on va difficilement tomber d'accord sur ce coup là :##06:
Je n'avais pas vraiment fini, mais avant de me lancer dans le retour à la théorie, je te cite :
superloupiot a écrit:(...)
Pour moi, le tableau montre juste l'effet du pouvoir tampon du KH. Plus le KH est élevé, et plus le pH sera élevé en présence d'une même quantité de substance acide. (...)
L'effet tampon ce n'est pas tout à fait ça.
Plus le KH est élevé, moins le pH sera susceptible de varier lors de l'ajout d'une quantité d'acide.
Ensuite tu affirmes :
superloupiot a écrit:(...)
Donc, il est faux de dire (je l'ai déjà souvent entendu) que le pH varie moins lorsque le KH est élevé. (...)
Et bien si, tu ne vas pas réinventer la science par l'interprétation fausse d'un tableau.
Voir mon explication ci-dessus (et démonstration plus tard).
Les tableaux de pH/KH donnant le taux de CO2 dissous :
. ne sont valables que si seuls les couples CO2/HCO3-/CO3-- régissent l'équilibre acido-basique de l'eau.
Avec un peu de tourbe par exemple, ça ne s'applique plus.
. se lisent pour un KH donné : on voit qu'ensuite à la mesure du pH on en déduit le taux de CO2 dissous, ou inversement que plus on injecte du CO2 qui pourra se dissoudre, on fera baisser le pH.
La régulation du pH pâr le CO2 est une façon élégante de le contrôler tout en maintenant un taux de CO2 correct pour les plantes.
. Toutes tentatives d'extrapolation comme tu le fais superloupiot d'une ligne à une autre (avec le KH que tu fais varier) sont souvent fausses.
_________________
Mes bacs : 240l planté/64l "Walstad"/Nano 20l/Nano 30l/Nano Reef 80l
"Walstad" = sans filtre, sans changements d'eau, substrat : terre + gravier



 Ha-DêAquariophile averti
Ha-DêAquariophile averti
 Nombre de messages : 4176
Nombre de messages : 4176
Age : 55
Localisation : Paris
Emploi : DG
Date d'inscription : 09/04/2012
 Re: PH ne descend pas
Re: PH ne descend pas
Jeu 29 Jan 2015 - 23:45
Lorsqu'on injecte du CO2 gazeux, on a la réaction suivante :
CO2g + H2O <-> H2CO3aq avec "g" pour gazeux et "aq" pour aqueux.
Tout le CO2 ne va cependant pas se dissoudre, il y a des pertes (bulles de CO2 atteignant la surface).
On a ensuite la réaction :
H2CO3 + H2O <-> HCO3- + H3O(+)
Mais la transformation n'est pas complète comme on l'aurait avec l'acide chlorhydrique (NaCl), on dit que H2CO3 est un acide faible.
Les ions H3O(+) produits sont néanmoins la raison de la baisse du pH.
Il y a aussi l'autre couple acido-basique :
HCO3- + H2O <-> CO3-- + H3O(+)
Mais on verra plus tard que pour les pH de nos bacs, cette dernière réaction n'est pas primordiale.
Le KH est la concentration molaire en ions HCO3- provenant des alcalino-terreux, essentiellement pour nous combinés aux ions Calcium et Magnésium.
En voulant augmenter son KH, on ajoute donc des sels (souvent de Calcium) qui vont augmenter la proportion d'ions HCO3- et donc influencer toutes les équations ci-dessus.
Augmenter le KH ne maintient pas le taux de H2CO3 constant.
Il faut avoir les courbes ci-dessous en tête :

Le point 1 est à pH 6,3.
On voit qu'au delà et avant pH 10, la forme HCO3- est majoritaire.
Pour notre étude, on se focalisera sur le couple acido-basique H2CO3 / HCO3-.
Comme déjà dit c'est un acide faible.
Si on ajoute à une solution basique avec des ions HCO3-, un acide fort (volume en abscisse), on a une courbe de ce type avec le pH en ordonnée :
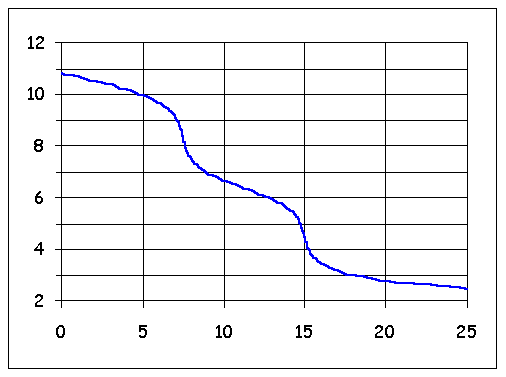
On voit qu'il y a une zone autour de laquelle le pH reste à peu près constant malgré l'ajout de l'acide, c'est ça l'effet tampon.
Les ions HCO3- tamponnent le pH et l'ajout d'acide ou de base, ne fait pas varier le pH autant qu'attendu.
Plus le KH est élevé, plus le pH sera donc tamponné.
Si on revient à cette courbe :

On voit aussi qu'en se rapprochant du pH 6, on a plus de forme CO2aq (ou H2CO3) qui est la principale assimilée par les plantes.
Donc avec un KH plus faible, en injectant du CO2, la conséquence sera une baisse du pH et du H2CO3 en plus importante quantité disponible pour nos attentes.
On ne peut donc se contenter des tableaux de pH/KH/CO2 dissous pour comprendre la chimie des solutions aqueuses, avec ici le cas précis de l'acide faible carbonique (H2CO3) dans les domaines classiques de pH de nos bacs d'eau douce.
CO2g + H2O <-> H2CO3aq avec "g" pour gazeux et "aq" pour aqueux.
Tout le CO2 ne va cependant pas se dissoudre, il y a des pertes (bulles de CO2 atteignant la surface).
On a ensuite la réaction :
H2CO3 + H2O <-> HCO3- + H3O(+)
Mais la transformation n'est pas complète comme on l'aurait avec l'acide chlorhydrique (NaCl), on dit que H2CO3 est un acide faible.
Les ions H3O(+) produits sont néanmoins la raison de la baisse du pH.
Il y a aussi l'autre couple acido-basique :
HCO3- + H2O <-> CO3-- + H3O(+)
Mais on verra plus tard que pour les pH de nos bacs, cette dernière réaction n'est pas primordiale.
Le KH est la concentration molaire en ions HCO3- provenant des alcalino-terreux, essentiellement pour nous combinés aux ions Calcium et Magnésium.
En voulant augmenter son KH, on ajoute donc des sels (souvent de Calcium) qui vont augmenter la proportion d'ions HCO3- et donc influencer toutes les équations ci-dessus.
Augmenter le KH ne maintient pas le taux de H2CO3 constant.
Il faut avoir les courbes ci-dessous en tête :

Le point 1 est à pH 6,3.
On voit qu'au delà et avant pH 10, la forme HCO3- est majoritaire.
Pour notre étude, on se focalisera sur le couple acido-basique H2CO3 / HCO3-.
Comme déjà dit c'est un acide faible.
Si on ajoute à une solution basique avec des ions HCO3-, un acide fort (volume en abscisse), on a une courbe de ce type avec le pH en ordonnée :

On voit qu'il y a une zone autour de laquelle le pH reste à peu près constant malgré l'ajout de l'acide, c'est ça l'effet tampon.
Les ions HCO3- tamponnent le pH et l'ajout d'acide ou de base, ne fait pas varier le pH autant qu'attendu.
Plus le KH est élevé, plus le pH sera donc tamponné.
Si on revient à cette courbe :

On voit aussi qu'en se rapprochant du pH 6, on a plus de forme CO2aq (ou H2CO3) qui est la principale assimilée par les plantes.
Donc avec un KH plus faible, en injectant du CO2, la conséquence sera une baisse du pH et du H2CO3 en plus importante quantité disponible pour nos attentes.
On ne peut donc se contenter des tableaux de pH/KH/CO2 dissous pour comprendre la chimie des solutions aqueuses, avec ici le cas précis de l'acide faible carbonique (H2CO3) dans les domaines classiques de pH de nos bacs d'eau douce.
_________________
Mes bacs : 240l planté/64l "Walstad"/Nano 20l/Nano 30l/Nano Reef 80l
"Walstad" = sans filtre, sans changements d'eau, substrat : terre + gravier



 superloupiotMembre : Habitué
superloupiotMembre : Habitué
 Nombre de messages : 835
Nombre de messages : 835
Localisation : Belgique
Emploi : Electronicien
Date d'inscription : 08/09/2013
 Re: PH ne descend pas
Re: PH ne descend pas
Ven 30 Jan 2015 - 0:37
Hello Ha-Dê,
Désolé, mais je ne suis pas d'accord avec toi.
Toutes les courbes que tu montres là sont les courbes d'une réaction à l'équilibre, c'est à dire les courbes lorsque tu n'injectes pas de CO2.
Lorsque tu injectes du CO2, une partie va se dissoudre et former le H2CO3 en grande quantité, et cela ne dépend pas du KH.
Il n'y a d'ailleurs aucune raison que le CO2 ne se dissolve pas. Il va rencontrer en grande quantité des molécules d'eau et formera H2CO3.
Cette injection va perturber l'équilibre de tes équations parce que tu n'est pas dans un système ou tu as un certain nombre de molécules qui se combinent et se recombinent, mais tu es dans un système ou tu apportes en permanence du CO2. Et donc, il n'y aura pas des recombinaisons à l'infini entre le CO2 et les ions du KH car ces ions sont en nombre fini et ne vont pas augmenter parce que tu apportes du CO2.
Par contre, du point de vue du CO2, la molécule H2O parraît être en nombre infini -> la réaction entre le CO2 et H2O dépendra à peine des autres molécules/ions.
Pour moi, une très faible fraction de H2CO3 va se décomposer et réagir avec le KH. Le reste va rester sous forme de H2CO3 et soit se dégazer (mais être remplacer par du nouveau CO2 injecté), soit être consommé par les plantes.
C'est la faible fraction qui se décompose qui va modifier le pH de ton eau. Le KH ne fera que tamponner et maintiendra ton pH d'autant plus haut qu'il peut tamponner ce H2CO3 qui va se décomposer.
Mais dans tous les cas, cette masse de CO2 que tu vas constamment injecter va se dissoudre de la même manière et former du H2CO3.
Cette dissolution dépendra uniquement de la température de ton eau et de la pression atmosphérique (et très très peu du KH de ton eau).
Concernant ta remarque de tout à l'heure, pour moi tu interprètes le tableau à l'envers.
Les concentration de CO2 que l'on donne dans ce tableau représentent les concentrations de CO2 dissoutes et non pas le CO2 que l'on injecte.
Il n'est inscrit nulle part que ce tableau indique que l'on doit injecter plus ou moins de CO2 pour arriver à une concentration de CO2 dissout donnée pour un KH différent.
Ce tableau indique seulement la valeur que prendra le pH de ton eau en présence d'un KH de X et d'une concentration en CO2 dissout de Y.
Ce tableau est issu de cette simple formule : pH = 6.37 + log ( (12.839 * dKH) / CO2
Désolé, mais je ne suis pas d'accord avec toi.
Toutes les courbes que tu montres là sont les courbes d'une réaction à l'équilibre, c'est à dire les courbes lorsque tu n'injectes pas de CO2.
Lorsque tu injectes du CO2, une partie va se dissoudre et former le H2CO3 en grande quantité, et cela ne dépend pas du KH.
Il n'y a d'ailleurs aucune raison que le CO2 ne se dissolve pas. Il va rencontrer en grande quantité des molécules d'eau et formera H2CO3.
Cette injection va perturber l'équilibre de tes équations parce que tu n'est pas dans un système ou tu as un certain nombre de molécules qui se combinent et se recombinent, mais tu es dans un système ou tu apportes en permanence du CO2. Et donc, il n'y aura pas des recombinaisons à l'infini entre le CO2 et les ions du KH car ces ions sont en nombre fini et ne vont pas augmenter parce que tu apportes du CO2.
Par contre, du point de vue du CO2, la molécule H2O parraît être en nombre infini -> la réaction entre le CO2 et H2O dépendra à peine des autres molécules/ions.
Pour moi, une très faible fraction de H2CO3 va se décomposer et réagir avec le KH. Le reste va rester sous forme de H2CO3 et soit se dégazer (mais être remplacer par du nouveau CO2 injecté), soit être consommé par les plantes.
C'est la faible fraction qui se décompose qui va modifier le pH de ton eau. Le KH ne fera que tamponner et maintiendra ton pH d'autant plus haut qu'il peut tamponner ce H2CO3 qui va se décomposer.
Mais dans tous les cas, cette masse de CO2 que tu vas constamment injecter va se dissoudre de la même manière et former du H2CO3.
Cette dissolution dépendra uniquement de la température de ton eau et de la pression atmosphérique (et très très peu du KH de ton eau).
Concernant ta remarque de tout à l'heure, pour moi tu interprètes le tableau à l'envers.
Les concentration de CO2 que l'on donne dans ce tableau représentent les concentrations de CO2 dissoutes et non pas le CO2 que l'on injecte.
Il n'est inscrit nulle part que ce tableau indique que l'on doit injecter plus ou moins de CO2 pour arriver à une concentration de CO2 dissout donnée pour un KH différent.
Ce tableau indique seulement la valeur que prendra le pH de ton eau en présence d'un KH de X et d'une concentration en CO2 dissout de Y.
Ce tableau est issu de cette simple formule : pH = 6.37 + log ( (12.839 * dKH) / CO2
 laurent 59Membre : Habitué
laurent 59Membre : Habitué
 Nombre de messages : 874
Nombre de messages : 874
Age : 39
Localisation : merville
Date d'inscription : 10/01/2012
 Re: PH ne descend pas
Re: PH ne descend pas
Ven 30 Jan 2015 - 15:54
salut
moi je ne pige rien à la chimie :##06:
mauvaise façon de lire le tableau.
le tableau donne une indication du taux de co2 dissout en fonction du kh et du ph mesurés avec nos tests.
ainsi on sait si on est dans la bonne fourchette de co2 dissout et non pas dans le sens que tu le dis.
superloupiot a écrit:
Ce tableau indique seulement la valeur que prendra le pH de ton eau en présence d'un KH de X et d'une concentration en CO2 dissout de Y.
moi je ne pige rien à la chimie :##06:
mauvaise façon de lire le tableau.
le tableau donne une indication du taux de co2 dissout en fonction du kh et du ph mesurés avec nos tests.
ainsi on sait si on est dans la bonne fourchette de co2 dissout et non pas dans le sens que tu le dis.
 Re: PH ne descend pas
Re: PH ne descend pas
Ven 30 Jan 2015 - 18:36
@superloupiot
Non non, Ha-Dê a bien raison.
Il n' y a pas de distinctions entre le CO2 injecté et celui présent : du CO2, c' est du CO2.
Evidemment, si on en injecte, il y en a plus ... pas de surprise ici !
Dire que c' est une équation "à l' équilibre" est faux : cela reviendrait à dire qu' on a ici un cas particulier, ce qui est aussi faux.
Le tableau se lit par ailleurs dans le sens qu 'on veut.
Aussi, les courbes de rapport données se valent bien INDÉPENDAMMENT du KH.
Dire que le KH n' a rien à voir avec cela est faux, tout autant que de dire qu' une simple fraction de celui-ci va réagir.
Si cela était vrai, pourquoi s' attarder tellement sur cette valeur alors ? Pourquoi s' en préoccuper ?
Il n' y a pas à être d' accord ou pas, je ne pense pas.
La courbe nous indique, quand on connait le pH, de savoir où on en est niveau RAPPORT entre les différentes formes de carbonates présents dans l' eau. On voit clairement qu' en dessous de 6.3 on a du CO2 dissout et c' est ce qui nous intéresse.
Elle ne nous indique, en effet, en RIEN la QUANTITÉ, ce qui est aussi exact. Bien évidemment, il ne peut y avoir recombinaison avec Ca et Mg que dans la mesure de leur présence qui est évidemment finie. Bien sûr, si ces taux de Ca et Mg sont trop élevés, il faudrait injecté beaucoup trop de CO2 pour que tout se recombinent : autrement dit, le CO2 fonctionne pour de l' eau déjà douce, jamais pour de l' eau dure.
Dans le cas contraire, bien sûr les recombinaisons sont plus rare et on en arrive bien à ce qu' on souhaite : une baisse du pH et plus de CO2 dissous ...
Non non, Ha-Dê a bien raison.
Il n' y a pas de distinctions entre le CO2 injecté et celui présent : du CO2, c' est du CO2.
Evidemment, si on en injecte, il y en a plus ... pas de surprise ici !
Dire que c' est une équation "à l' équilibre" est faux : cela reviendrait à dire qu' on a ici un cas particulier, ce qui est aussi faux.
Le tableau se lit par ailleurs dans le sens qu 'on veut.
Aussi, les courbes de rapport données se valent bien INDÉPENDAMMENT du KH.
Dire que le KH n' a rien à voir avec cela est faux, tout autant que de dire qu' une simple fraction de celui-ci va réagir.
Si cela était vrai, pourquoi s' attarder tellement sur cette valeur alors ? Pourquoi s' en préoccuper ?
Il n' y a pas à être d' accord ou pas, je ne pense pas.
La courbe nous indique, quand on connait le pH, de savoir où on en est niveau RAPPORT entre les différentes formes de carbonates présents dans l' eau. On voit clairement qu' en dessous de 6.3 on a du CO2 dissout et c' est ce qui nous intéresse.
Elle ne nous indique, en effet, en RIEN la QUANTITÉ, ce qui est aussi exact. Bien évidemment, il ne peut y avoir recombinaison avec Ca et Mg que dans la mesure de leur présence qui est évidemment finie. Bien sûr, si ces taux de Ca et Mg sont trop élevés, il faudrait injecté beaucoup trop de CO2 pour que tout se recombinent : autrement dit, le CO2 fonctionne pour de l' eau déjà douce, jamais pour de l' eau dure.
Dans le cas contraire, bien sûr les recombinaisons sont plus rare et on en arrive bien à ce qu' on souhaite : une baisse du pH et plus de CO2 dissous ...
 Ha-DêAquariophile averti
Ha-DêAquariophile averti
 Nombre de messages : 4176
Nombre de messages : 4176
Age : 55
Localisation : Paris
Emploi : DG
Date d'inscription : 09/04/2012
 Re: PH ne descend pas
Re: PH ne descend pas
Sam 31 Jan 2015 - 8:42
superloupiot a écrit:(...)
Ce tableau est issu de cette simple formule : pH = 6.37 + log ( (12.839 * dKH) / CO2
Cette formule n'est pas si simple justement.
Elle fait appel à la chimie que j'ai détaillée auparavant avec des hypothèses bien précises.
Si tu ne sais pas la retrouver, je l'expliquerai un peu plus tard.
Il va sans dire qu'il faille un minimum de connaissances en chimie des solutions aqueuses (constantes d'acidité en particulier) et lois fondamentales comme la conservation de la masse, neutralité électrique des solutions aqueuses etc.
Le but n'est pas ici de recréer une théorie.
Si le sujet vous intéresse, vous pouvez l'étudier ou réviser vos bases (terminales scientifiques).
Mais faites très attention à l'extrapolation de certains tableaux si vous ne maîtrisez pas le sujet.
Surtout pour ceux qui pourraient lire vos posts et prendre pour argent comptant vos propos, chose commune sur les forums...
_________________
Mes bacs : 240l planté/64l "Walstad"/Nano 20l/Nano 30l/Nano Reef 80l
"Walstad" = sans filtre, sans changements d'eau, substrat : terre + gravier



Page 1 sur 3 • 1, 2, 3 

Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum

