 Ha-DêAquariophile averti
Ha-DêAquariophile averti
 Nombre de messages : 4178
Nombre de messages : 4178
Age : 55
Localisation : Paris
Emploi : DG
Date d'inscription : 09/04/2012
 Tableaux du taux de CO2 en fonction du KH et pH : théorie
Tableaux du taux de CO2 en fonction du KH et pH : théorie
Sam 31 Jan 2015 - 22:32
Nous sommes beaucoup à utiliser des tableaux qui circulent sur le net et donnant pour un KH donné et le pH du bac, le taux de CO2 dissous, comme celui-là :
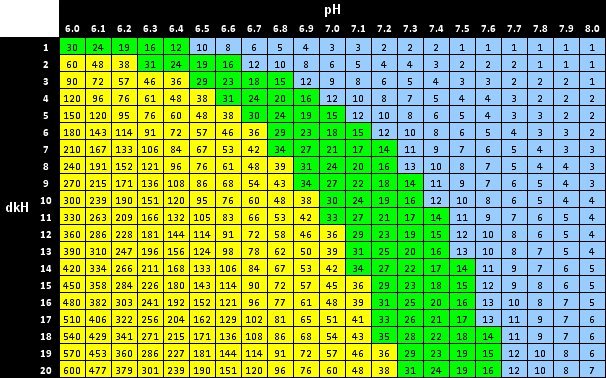
On a de plus la zone idéale (en vert ici) à la fois pour une bonne pousse des plantes sans dommage pour les poissons.
Toutefois je vois souvent une mauvaise utilisation d'une telle table et je voulais donc donner quelques éléments de théorie qui expliquent d'où ces résultats proviennent, sans toutefois faire des rappels systématiques sur les notions que je vais aborder.
Enfin je ne suis pas chimiste professionnel donc certaines tournures pourraient parfois ne pas satisfaire totalement les spécialistes, sans toutefois je pense remettre en question le propos.
Lorsque l'on injecte du CO2(g) (gazeux) dans nos bacs, il se dissout en partie suivant cette réaction :
CO2(g) + H2O <--> H2CO3(aq) (aqueux)
H2CO3 aussi appelé acide carbonique se décompose ainsi :
H2CO3 +H2O <--> HCO3- + H3O(+)
On a aussi la réaction :
HCO3- + H2O <--> CO3-- + H3O(+)
Il y a donc en fait 3 formes qui coexistent :
. H2CO3 (acide carbonique) ou CO2 dissout
. HCO3- (ion bicarbonate)
. CO3-- (ion carbonate)
On a les couples acido-basiques :
. H2CO3/HCO3-
avec la constante d'acidité Ka1 = [HCO3-]*[H3O+]/[H2CO3] (1)
. HCO3-/CO3--
avec la constante d'acidité Ka2 = [CO3--]*[H3O+]/[HCO3-] (2)
L'acide carbonique H2CO3 étant la forme dissoute du CO2 qui nous intéresse pour nos plantes (que je noterai CO2aq puis CO2 en définitive), on peut donc en déterminer la quantité par la relation (1) qui s'écrit aussi :
pH = pKa1 + log([HCO3-]/[CO2aq])
Je peux mesurer le pH.
pKa1 est une constante dont je reparlerai plus tard.
[HCO3-] est la concentration (molaire) en ions bicarbonates, ça ne vous rappelle rien?
Or on peut mesurer le KH de son bac qui a un lien avec ces ions, on pourra alors en déduire le taux de CO2 dissout.
Comment déterminer la concentration en ions bicarbonates [HCO3-]?
Rappel : définition du KH
Le KH ou dureté carbonatée représente la quantité d'ions bicarbonates et carbonates associés aux alcalino-terreux, c'est à dire essentiellement dans nos bacs (d'eau douce ou marins) aux ions calcium et magnésium.
Le KH ne tient donc pas seulement compte des ions bicarbonates HCO3- qui seuls nous intéressent dans notre équation.
Première hypothèse :
Nous allons nous concentrer sur les bacs dont le pH peut être entre 6 et 8,5.
La répartition des formes H2CO3/HCO3-/CO3-- suivant le pH est la suivante :

On voit que si on ne considère que des pH compris entre 6 et 8,5, les ions carbonates CO3-- seront ultra-minoritaires par rapport aux autres formes et en particulier les ions bicarbonates HCO3-.
Par conséquent la mesure du KH nous rapportera directement aux ions bicarbonates HCO3- et eux-seuls.
Mais quelle est la relation réelle entre la mesure du KH et la concentration en ions bicarbonates [HCO3-]?
Deuxième hypothèse :
Nous allons nous concentrer sur les bacs d'eau douce en supposant que les ions bicarbonates ne sont liés qu'à des ions calcium (voir note (*)).
Dans ce cas, un degré de KH représente le pouvoir basique des ions carbonates CO3-- et bicarbonates HCO3- présents dans une solution équivalente de CaCO3 à 17,848 ppm (ou mg/L).
La masse molaire de CaCO3 est 40 + 12 + 3*16 = 100 g/mol.
Le degré de KH (ou dKH) représente le pouvoir basique d'une solution de CaCO3 à 0,17848 mmol/L.
On peut écrire la mesure du KH ainsi :
dKH = [CaCO3]équivalent/0,17848
ou [CaCO3]équivalent = 0,17848*dKH
En réécrivant les relations entre les formes comme suit :
H2CO3 <--> H(+) + HCO3- <--> 2H(+) + CO3--
on voit que la faculté de neutraliser un acide par le CO3-- est double de celui de HCO3-, l'ion bicarbonate qui représente essentiellement la forme ionique dans l'eau de nos bacs.
La concentration [HCO3-] que l'on cherche à déterminer a donc un pouvoir équivalent 2 fois plus faible, soit :
[CaCO3]équivalent = [HCO3-]/2
Et donc finalement :
[HCO3-] = 2*0,17848*dKH(mesuré du bac)
(*) Corollaire : si des ions (bi)carbonates sont présents avec une origine autre, comme par exemple une résine échangeuse d'ions qui va remplacer des acalino-terreux par du sodium, alors cette hypothèse n'est plus valable.
En reportant dans notre formule principale, on obtient :
pH = pKa1 + log(2*0,17848*dKH/[CO2aq])
La masse molaire du CO2 est 12 + 2*16 = 44 g/mol.
Donc si on note simplement CO2 le taux de CO2 dissout dans notre bac en ppm (ou mg/L), on a :
[CO2aq] = CO2 / 44 en mol/L.
Finalement :
pH = pKa1 + log(15,70*dKH/CO2)
Reste à déterminer pKa1 et c'est fini!
Troisième hypothèse : conditions pour la détermination de pKa1
La valeur pKa1 dépend de la température et de la salinité de l'eau.
Même si l'eau du bac n'est pas pure (osmosée à 100%), nous considérerons la valeur théorique à 25°C qui est de 6,35.
Cela n'affecte pas considérablement le calcul de la valeur du taux de CO2 qui nous intéresse, du moins avec la précision dont nous avons besoin.
En conclusion,
pH = 6,35 + log(15,70*dKH/CO2)
ou encore
CO2(ppm) = 15,7 * dKH * E(6,35 - pH)
Note :
Les tableaux que vous consultez peuvent donner des résultats légèrement différents en fonction de l'approximation éventuelle faite sur les masses molaires (avec peu d'influence), sur le pKa1 bien sûr et enfin sur la définition exacte du KH qui diffère parfois et donne un coefficient plus faible que 15,7 (on trouve alors des valeurs environ 10-15% plus faibles mais ce n'est pas très grave pour notre usage).
Ces tableaux ne peuvent être utilisés si vous avez ajouté à votre eau du bac des composés actifs comme de la tourbe, des fruits d'aulne car la présence d'autres couples acido-basiques peut remettre en question plusieurs hypothèses et approximations de façon significative.
Edit : faute de frappe sur le log.

On a de plus la zone idéale (en vert ici) à la fois pour une bonne pousse des plantes sans dommage pour les poissons.
Toutefois je vois souvent une mauvaise utilisation d'une telle table et je voulais donc donner quelques éléments de théorie qui expliquent d'où ces résultats proviennent, sans toutefois faire des rappels systématiques sur les notions que je vais aborder.
Enfin je ne suis pas chimiste professionnel donc certaines tournures pourraient parfois ne pas satisfaire totalement les spécialistes, sans toutefois je pense remettre en question le propos.
Lorsque l'on injecte du CO2(g) (gazeux) dans nos bacs, il se dissout en partie suivant cette réaction :
CO2(g) + H2O <--> H2CO3(aq) (aqueux)
H2CO3 aussi appelé acide carbonique se décompose ainsi :
H2CO3 +H2O <--> HCO3- + H3O(+)
On a aussi la réaction :
HCO3- + H2O <--> CO3-- + H3O(+)
Il y a donc en fait 3 formes qui coexistent :
. H2CO3 (acide carbonique) ou CO2 dissout
. HCO3- (ion bicarbonate)
. CO3-- (ion carbonate)
On a les couples acido-basiques :
. H2CO3/HCO3-
avec la constante d'acidité Ka1 = [HCO3-]*[H3O+]/[H2CO3] (1)
. HCO3-/CO3--
avec la constante d'acidité Ka2 = [CO3--]*[H3O+]/[HCO3-] (2)
L'acide carbonique H2CO3 étant la forme dissoute du CO2 qui nous intéresse pour nos plantes (que je noterai CO2aq puis CO2 en définitive), on peut donc en déterminer la quantité par la relation (1) qui s'écrit aussi :
pH = pKa1 + log([HCO3-]/[CO2aq])
Je peux mesurer le pH.
pKa1 est une constante dont je reparlerai plus tard.
[HCO3-] est la concentration (molaire) en ions bicarbonates, ça ne vous rappelle rien?
Or on peut mesurer le KH de son bac qui a un lien avec ces ions, on pourra alors en déduire le taux de CO2 dissout.
Comment déterminer la concentration en ions bicarbonates [HCO3-]?
Rappel : définition du KH
Le KH ou dureté carbonatée représente la quantité d'ions bicarbonates et carbonates associés aux alcalino-terreux, c'est à dire essentiellement dans nos bacs (d'eau douce ou marins) aux ions calcium et magnésium.
Le KH ne tient donc pas seulement compte des ions bicarbonates HCO3- qui seuls nous intéressent dans notre équation.
Première hypothèse :
Nous allons nous concentrer sur les bacs dont le pH peut être entre 6 et 8,5.
La répartition des formes H2CO3/HCO3-/CO3-- suivant le pH est la suivante :

On voit que si on ne considère que des pH compris entre 6 et 8,5, les ions carbonates CO3-- seront ultra-minoritaires par rapport aux autres formes et en particulier les ions bicarbonates HCO3-.
Par conséquent la mesure du KH nous rapportera directement aux ions bicarbonates HCO3- et eux-seuls.
Mais quelle est la relation réelle entre la mesure du KH et la concentration en ions bicarbonates [HCO3-]?
Deuxième hypothèse :
Nous allons nous concentrer sur les bacs d'eau douce en supposant que les ions bicarbonates ne sont liés qu'à des ions calcium (voir note (*)).
Dans ce cas, un degré de KH représente le pouvoir basique des ions carbonates CO3-- et bicarbonates HCO3- présents dans une solution équivalente de CaCO3 à 17,848 ppm (ou mg/L).
La masse molaire de CaCO3 est 40 + 12 + 3*16 = 100 g/mol.
Le degré de KH (ou dKH) représente le pouvoir basique d'une solution de CaCO3 à 0,17848 mmol/L.
On peut écrire la mesure du KH ainsi :
dKH = [CaCO3]équivalent/0,17848
ou [CaCO3]équivalent = 0,17848*dKH
En réécrivant les relations entre les formes comme suit :
H2CO3 <--> H(+) + HCO3- <--> 2H(+) + CO3--
on voit que la faculté de neutraliser un acide par le CO3-- est double de celui de HCO3-, l'ion bicarbonate qui représente essentiellement la forme ionique dans l'eau de nos bacs.
La concentration [HCO3-] que l'on cherche à déterminer a donc un pouvoir équivalent 2 fois plus faible, soit :
[CaCO3]équivalent = [HCO3-]/2
Et donc finalement :
[HCO3-] = 2*0,17848*dKH(mesuré du bac)
(*) Corollaire : si des ions (bi)carbonates sont présents avec une origine autre, comme par exemple une résine échangeuse d'ions qui va remplacer des acalino-terreux par du sodium, alors cette hypothèse n'est plus valable.
En reportant dans notre formule principale, on obtient :
pH = pKa1 + log(2*0,17848*dKH/[CO2aq])
La masse molaire du CO2 est 12 + 2*16 = 44 g/mol.
Donc si on note simplement CO2 le taux de CO2 dissout dans notre bac en ppm (ou mg/L), on a :
[CO2aq] = CO2 / 44 en mol/L.
Finalement :
pH = pKa1 + log(15,70*dKH/CO2)
Reste à déterminer pKa1 et c'est fini!
Troisième hypothèse : conditions pour la détermination de pKa1
La valeur pKa1 dépend de la température et de la salinité de l'eau.
Même si l'eau du bac n'est pas pure (osmosée à 100%), nous considérerons la valeur théorique à 25°C qui est de 6,35.
Cela n'affecte pas considérablement le calcul de la valeur du taux de CO2 qui nous intéresse, du moins avec la précision dont nous avons besoin.
En conclusion,
pH = 6,35 + log(15,70*dKH/CO2)
ou encore
CO2(ppm) = 15,7 * dKH * E(6,35 - pH)
Note :
Les tableaux que vous consultez peuvent donner des résultats légèrement différents en fonction de l'approximation éventuelle faite sur les masses molaires (avec peu d'influence), sur le pKa1 bien sûr et enfin sur la définition exacte du KH qui diffère parfois et donne un coefficient plus faible que 15,7 (on trouve alors des valeurs environ 10-15% plus faibles mais ce n'est pas très grave pour notre usage).
Ces tableaux ne peuvent être utilisés si vous avez ajouté à votre eau du bac des composés actifs comme de la tourbe, des fruits d'aulne car la présence d'autres couples acido-basiques peut remettre en question plusieurs hypothèses et approximations de façon significative.
Edit : faute de frappe sur le log.
_________________
Mes bacs : 240l planté/64l "Walstad"/Nano 20l/Nano 30l/Nano Reef 80l
"Walstad" = sans filtre, sans changements d'eau, substrat : terre + gravier



 waliounConseiller
waliounConseiller
 Nombre de messages : 4276
Nombre de messages : 4276
Age : 88
Localisation : 06110 Bassin Cannois
Emploi : retraité
Date d'inscription : 08/08/2012
 Re: Tableaux du taux de CO2 en fonction du KH et pH : théorie
Re: Tableaux du taux de CO2 en fonction du KH et pH : théorie
Sam 31 Jan 2015 - 23:19
Salut Ha-Dé,
Il est regrettable qu'on y inclus pas aussi la vitesse du vent et l'âge du capitaine !.. :##17:
Ces tableaux oublient, généralement, de préciser une chose importante c'est qu'il est valable sous certaines conditions de l'eau de nos aquarium et de ce qu'elles contiennent. Comme précisé d'ailleurs dans ton message.
Je suis étonné de voir abattre en flèche ceux qui utilisent des tests en bandes, qui ne sont pas peu fiables mais très imprécises, alors que j'en vois beaucoup qui citent ce tableau comme une bible, alors qu'il existe des test en gouttes beaucoup plus fiables pour mesurer :
Le PH
Le KH
Le Co2
PS : Jbl vient de sortir une appli pour smartphone, avec bandelettes pro scan, pour avoir les mesures sur écran smartphone.
Il est regrettable qu'on y inclus pas aussi la vitesse du vent et l'âge du capitaine !.. :##17:
Ces tableaux oublient, généralement, de préciser une chose importante c'est qu'il est valable sous certaines conditions de l'eau de nos aquarium et de ce qu'elles contiennent. Comme précisé d'ailleurs dans ton message.
Je suis étonné de voir abattre en flèche ceux qui utilisent des tests en bandes, qui ne sont pas peu fiables mais très imprécises, alors que j'en vois beaucoup qui citent ce tableau comme une bible, alors qu'il existe des test en gouttes beaucoup plus fiables pour mesurer :
Le PH
Le KH
Le Co2
PS : Jbl vient de sortir une appli pour smartphone, avec bandelettes pro scan, pour avoir les mesures sur écran smartphone.
_________________
Cordialement
Henri,
Mon Rio 180

 Re: Tableaux du taux de CO2 en fonction du KH et pH : théorie
Re: Tableaux du taux de CO2 en fonction du KH et pH : théorie
Dim 1 Fév 2015 - 0:02
Merci pour ta démonstration Ha-Dê.
J' avoue ne plus me remémorer moi-même de toute cette technicité, d' ailleurs je ne me rappelles pas si en mon temps on avait vraiment tout ça au programme .. les couples acides/bases oui, "le saut de pH" pour les acides forts oui, le reste ...
Petite précision peut-être utile :
Tu rappelles ici, entre autre ici, la définition du Kh en degrés alemands et son équivalent en CaCO3.
On peut également se servir de cela pour, par exemple, calculer la quantité de bicarbonate de soude à rajouter à de l' eau pour augmenter le KH justement, en complétant avec la masse molélaire de celle-ci (bref, un produit en croix ...) ou retrouver le KH d' une eau de source via ce qui figure sur l' étiquette de la bouteille.
On trouve en ligne des calculateurs qui font bien le calcul, mais sans donner les équations .... pfff..
Moi, je m' étais amusé, il y a 2-3 semaines, de refaire le calcul dans mon coin et j' avais effectivement retrouvé la chose .. d' où ma remarque ...
Par ailleurs, walioun a expliqué dans un autre post qu' on pouvait très bien mesurer le KH, le pH et le CO2 dissous via un drop checker pour constater, au final, que la valeur théorique du CO2 donné via le tableau n' est pas toujours celle lue sur le drop checker. Bien sûr, il va de soi qu' il n' y pas de tourbe/machinchose acide/etc ...
D' autre retours similaires de ce côté ?
La vache, on arrête pas le progrès ! Cette fois-ci, on sait d' où vient l' erreur ! C 'est le Gamut colorimétrique ! A moins que ce ne soit le profil colorimétrique de l' OS du smartphone ? Ah non, sans doute le capteur qui tire vers le rouge quand il fait sombre !! Tout bêtement ..
Croyez-moi, ayant fais de l' impression num. sur des machines pro, quand je vois ce genre de choses, cela me fait juste rire !
Toujours plus de scientisterie débile qui, grâce à l' appuie d' une touche transforme votre téléphone en "engin de labo", combien vont y croire ?
Peut -être qu' en rajoutant un réseau de diffraction on en fera aussi un spectroscope, un de ces jours ?
Bah, sinon, on pourras toujours faire des photos d' ovnis !
C' est bien la preuve que les industriels savent comment exciter notre idiotie autant que notre intelligence pour tout nous refourguer.
J' avoue ne plus me remémorer moi-même de toute cette technicité, d' ailleurs je ne me rappelles pas si en mon temps on avait vraiment tout ça au programme .. les couples acides/bases oui, "le saut de pH" pour les acides forts oui, le reste ...
Petite précision peut-être utile :
Tu rappelles ici, entre autre ici, la définition du Kh en degrés alemands et son équivalent en CaCO3.
On peut également se servir de cela pour, par exemple, calculer la quantité de bicarbonate de soude à rajouter à de l' eau pour augmenter le KH justement, en complétant avec la masse molélaire de celle-ci (bref, un produit en croix ...) ou retrouver le KH d' une eau de source via ce qui figure sur l' étiquette de la bouteille.
On trouve en ligne des calculateurs qui font bien le calcul, mais sans donner les équations .... pfff..
Moi, je m' étais amusé, il y a 2-3 semaines, de refaire le calcul dans mon coin et j' avais effectivement retrouvé la chose .. d' où ma remarque ...
Par ailleurs, walioun a expliqué dans un autre post qu' on pouvait très bien mesurer le KH, le pH et le CO2 dissous via un drop checker pour constater, au final, que la valeur théorique du CO2 donné via le tableau n' est pas toujours celle lue sur le drop checker. Bien sûr, il va de soi qu' il n' y pas de tourbe/machinchose acide/etc ...
D' autre retours similaires de ce côté ?
walinou a écrit:
PS : Jbl vient de sortir une appli pour smartphone, avec bandelettes pro scan, pour avoir les mesures sur écran smartphone.
La vache, on arrête pas le progrès ! Cette fois-ci, on sait d' où vient l' erreur ! C 'est le Gamut colorimétrique ! A moins que ce ne soit le profil colorimétrique de l' OS du smartphone ? Ah non, sans doute le capteur qui tire vers le rouge quand il fait sombre !! Tout bêtement ..
Croyez-moi, ayant fais de l' impression num. sur des machines pro, quand je vois ce genre de choses, cela me fait juste rire !
Toujours plus de scientisterie débile qui, grâce à l' appuie d' une touche transforme votre téléphone en "engin de labo", combien vont y croire ?
Peut -être qu' en rajoutant un réseau de diffraction on en fera aussi un spectroscope, un de ces jours ?
Bah, sinon, on pourras toujours faire des photos d' ovnis !
C' est bien la preuve que les industriels savent comment exciter notre idiotie autant que notre intelligence pour tout nous refourguer.
 Ha-DêAquariophile averti
Ha-DêAquariophile averti
 Nombre de messages : 4178
Nombre de messages : 4178
Age : 55
Localisation : Paris
Emploi : DG
Date d'inscription : 09/04/2012
 Re: Tableaux du taux de CO2 en fonction du KH et pH : théorie
Re: Tableaux du taux de CO2 en fonction du KH et pH : théorie
Dim 1 Fév 2015 - 0:09
Je ne connais pas cette appli, mais si on doit commencer par faire un calibrage colorimétrique comme on le fait avec les tests JBL et la fiole avec l'eau du bac sans ajouts comme témoin, ça pourrait marcher...
_________________
Mes bacs : 240l planté/64l "Walstad"/Nano 20l/Nano 30l/Nano Reef 80l
"Walstad" = sans filtre, sans changements d'eau, substrat : terre + gravier



 waliounConseiller
waliounConseiller
 Nombre de messages : 4276
Nombre de messages : 4276
Age : 88
Localisation : 06110 Bassin Cannois
Emploi : retraité
Date d'inscription : 08/08/2012
 Re: Tableaux du taux de CO2 en fonction du KH et pH : théorie
Re: Tableaux du taux de CO2 en fonction du KH et pH : théorie
Dim 1 Fév 2015 - 10:15
Voir là pour plus de detail :
http://www.reef-ocean.com/kits-multi-tests/353712-jbl-proscan-kit-de-tests-photometrique-en-bandelettes-avec-lecture-des-resultats-par-application-smartphone.html
Dans tous les cas je ne risque pas d'essayer, car mon tel. portable ne sait pas faire autre chose que téléphoner !!... :##17: :##17:
C'est en fait la camera du smart... qui scanne la languette spéciale et interprète la couleur, pour donner les mesures.
Je pense, même si je ne peut le faire, que ça vaut le coup d'essayer pour les possesseurs de smart., car l'appli est gratuit et la boite de 24 languettes scan est a 20 euros. Car on peut supposer que les résultats seront précis contrairement aux languettes ou il faut interpréter la couleur entre GH 7 et GH 14 par exemple !. :##23:
http://www.reef-ocean.com/kits-multi-tests/353712-jbl-proscan-kit-de-tests-photometrique-en-bandelettes-avec-lecture-des-resultats-par-application-smartphone.html
Dans tous les cas je ne risque pas d'essayer, car mon tel. portable ne sait pas faire autre chose que téléphoner !!... :##17: :##17:
C'est en fait la camera du smart... qui scanne la languette spéciale et interprète la couleur, pour donner les mesures.
Je pense, même si je ne peut le faire, que ça vaut le coup d'essayer pour les possesseurs de smart., car l'appli est gratuit et la boite de 24 languettes scan est a 20 euros. Car on peut supposer que les résultats seront précis contrairement aux languettes ou il faut interpréter la couleur entre GH 7 et GH 14 par exemple !. :##23:
_________________
Cordialement
Henri,
Mon Rio 180

 Zout42Membre : Nouveau
Zout42Membre : Nouveau
 Nombre de messages : 4
Nombre de messages : 4
Localisation : Var
Emploi : Retraite
Date d'inscription : 26/07/2015
 Tableaux du taux de Co2
Tableaux du taux de Co2
Dim 26 Juil 2015 - 15:41
Bonjour,
Effectivement l'utilisation de ce tableau n'est pas très claire.
Dans mon cas j'utilise Le JBL Ph Control.
pour un Kh ( test gouttes JBL) de 6,5 il fixe un Ph de 6,94
D'après le tableau la valeur cible de Co2 serait de 24 mg/l
Il manque un paramètre à mon avis --> durée
Mon aquarium à un volume utilisable de 450l maximum
D'autre part le compte bulles Co2 exact de Dennerlé indique :
1 bulle = 0,125 mg ( poids)
ou
1 bulle = 0,063 ml (volume )
J'aurais besoin de vos lumières pour un apport correct de Co2 et comprendre la logique du calcul
Cordialement
René
Effectivement l'utilisation de ce tableau n'est pas très claire.
Dans mon cas j'utilise Le JBL Ph Control.
pour un Kh ( test gouttes JBL) de 6,5 il fixe un Ph de 6,94
D'après le tableau la valeur cible de Co2 serait de 24 mg/l
Il manque un paramètre à mon avis --> durée
Mon aquarium à un volume utilisable de 450l maximum
D'autre part le compte bulles Co2 exact de Dennerlé indique :
1 bulle = 0,125 mg ( poids)
ou
1 bulle = 0,063 ml (volume )
J'aurais besoin de vos lumières pour un apport correct de Co2 et comprendre la logique du calcul
Cordialement
René
 AutentikMembre : Régulier
AutentikMembre : Régulier
 Nombre de messages : 232
Nombre de messages : 232
Localisation : Meurthe et Moselle (54)
Emploi : Géologue
Date d'inscription : 15/07/2015
 Re: Tableaux du taux de CO2 en fonction du KH et pH : théorie
Re: Tableaux du taux de CO2 en fonction du KH et pH : théorie
Dim 26 Juil 2015 - 15:50
Bonjour, ces calculs sont fait pour des pH proches de la neutralité, mais où est donc l'autoprotolyse de l'eau?
Je pense qu' elle n'y est pas pour rien dans vos marges d'erreur. )
)
Je pense qu' elle n'y est pas pour rien dans vos marges d'erreur.
 )
)  waliounConseiller
waliounConseiller
 Nombre de messages : 4276
Nombre de messages : 4276
Age : 88
Localisation : 06110 Bassin Cannois
Emploi : retraité
Date d'inscription : 08/08/2012
 Re: Tableaux du taux de CO2 en fonction du KH et pH : théorie
Re: Tableaux du taux de CO2 en fonction du KH et pH : théorie
Dim 26 Juil 2015 - 18:02
Salut Zout,
Pas très claire ta question, car elle viens derriere le Test Scan, par smartphone, qui donne les valeurs :
PH
KH
GH
Co2
etc...
Si Tu parle du tableau, des valeurs KH/PH/Co2, c'est une approximation, généralement fausse.
Que ce soit pour n'importe quelles valeurs, seuls les test dédiés sont valables.
Pas très claire ta question, car elle viens derriere le Test Scan, par smartphone, qui donne les valeurs :
PH
KH
GH
Co2
etc...
Si Tu parle du tableau, des valeurs KH/PH/Co2, c'est une approximation, généralement fausse.
Que ce soit pour n'importe quelles valeurs, seuls les test dédiés sont valables.
_________________
Cordialement
Henri,
Mon Rio 180

 Zout42Membre : Nouveau
Zout42Membre : Nouveau
 Nombre de messages : 4
Nombre de messages : 4
Localisation : Var
Emploi : Retraite
Date d'inscription : 26/07/2015
 Re: Tableaux du taux de CO2 en fonction du KH et pH : théorie
Re: Tableaux du taux de CO2 en fonction du KH et pH : théorie
Dim 26 Juil 2015 - 19:00
Je veux bien croire que ma question soit mal formulée.
Comment la formuler pour être compris et conseillé ?
Donc il est recommandé de procéder à un apport de Co2.
- en fc de quels paramètres
- Combien de gouttes
- Pendant combien de temps
A lire différents avis et sur différents forums vous avez tout et son contraire.
Donc existe t'il une méthode cohérente et une approche logique et fiable ?
Comment la formuler pour être compris et conseillé ?
Donc il est recommandé de procéder à un apport de Co2.
- en fc de quels paramètres
- Combien de gouttes
- Pendant combien de temps
A lire différents avis et sur différents forums vous avez tout et son contraire.
Donc existe t'il une méthode cohérente et une approche logique et fiable ?
 Ha-DêAquariophile averti
Ha-DêAquariophile averti
 Nombre de messages : 4178
Nombre de messages : 4178
Age : 55
Localisation : Paris
Emploi : DG
Date d'inscription : 09/04/2012
 Re: Tableaux du taux de CO2 en fonction du KH et pH : théorie
Re: Tableaux du taux de CO2 en fonction du KH et pH : théorie
Dim 26 Juil 2015 - 19:07
Achète simplement un test de ce type :
http://www.zone-aquatique.com/Test_permanent_CO2_+_pH_Dennerle_-_Mini-p13522.html
Ensuite en fonction de la valeur souhaitée, tu joues sur le bullage jour après jour, en mesurant à la même heure, le matin de préférence.
http://www.zone-aquatique.com/Test_permanent_CO2_+_pH_Dennerle_-_Mini-p13522.html
Ensuite en fonction de la valeur souhaitée, tu joues sur le bullage jour après jour, en mesurant à la même heure, le matin de préférence.
_________________
Mes bacs : 240l planté/64l "Walstad"/Nano 20l/Nano 30l/Nano Reef 80l
"Walstad" = sans filtre, sans changements d'eau, substrat : terre + gravier



 waliounConseiller
waliounConseiller
 Nombre de messages : 4276
Nombre de messages : 4276
Age : 88
Localisation : 06110 Bassin Cannois
Emploi : retraité
Date d'inscription : 08/08/2012
 Re: Tableaux du taux de CO2 en fonction du KH et pH : théorie
Re: Tableaux du taux de CO2 en fonction du KH et pH : théorie
Dim 26 Juil 2015 - 20:51
Zout42 a écrit:.....................A lire différents avis et sur différents forums vous avez tout et son contraire.
Donc existe t'il une méthode cohérente et une approche logique et fiable ?
C'est un peu normal, car chaque cas est un cas particulier puisque l'apport en Co2, dans un aquarium est fonction :
- Du volume de l'aquarium
- Du nombre et types de plantes.
- De la T° de l'eau (plus une eau est chaude moins elle stocke de gaz).
- Du diffuseur choisi
- Du débit du Co2 au diffuseur.
Donc comme te le dis HA-Dé, tu installe un test et tu augmente ou diminue le débit en fonction du taux en mg/l souhaité !. Généralement autour de 20 mg/L
_________________
Cordialement
Henri,
Mon Rio 180

 Zout42Membre : Nouveau
Zout42Membre : Nouveau
 Nombre de messages : 4
Nombre de messages : 4
Localisation : Var
Emploi : Retraite
Date d'inscription : 26/07/2015
 Re: Tableaux du taux de CO2 en fonction du KH et pH : théorie
Re: Tableaux du taux de CO2 en fonction du KH et pH : théorie
Dim 26 Juil 2015 - 21:14
Réponses intéressantes.
je vais m’orienter vers le test Co2 Dennerlé
Le modèle mini serait pour aquarium 125 l.
Le modèle maxi est prévu pour 250 l max.
Dans mon cas 450l réels.
Le principe est il toujours valable ?
je vais m’orienter vers le test Co2 Dennerlé
Le modèle mini serait pour aquarium 125 l.
Le modèle maxi est prévu pour 250 l max.
Dans mon cas 450l réels.
Le principe est il toujours valable ?
 waliounConseiller
waliounConseiller
 Nombre de messages : 4276
Nombre de messages : 4276
Age : 88
Localisation : 06110 Bassin Cannois
Emploi : retraité
Date d'inscription : 08/08/2012
 Re: Tableaux du taux de CO2 en fonction du KH et pH : théorie
Re: Tableaux du taux de CO2 en fonction du KH et pH : théorie
Mar 28 Juil 2015 - 13:35
Bonjour,
Un test Co2 détecte le taux de Co2 dans l'eau, je ne vois pas la différence, qu'il y ai 1 litre ou 1 M3 !... :##17:
Ou alors tu parle d'un diffuseur et non pas d'un test !...
Un test Co2 détecte le taux de Co2 dans l'eau, je ne vois pas la différence, qu'il y ai 1 litre ou 1 M3 !... :##17:
Ou alors tu parle d'un diffuseur et non pas d'un test !...
_________________
Cordialement
Henri,
Mon Rio 180

 Zout42Membre : Nouveau
Zout42Membre : Nouveau
 Nombre de messages : 4
Nombre de messages : 4
Localisation : Var
Emploi : Retraite
Date d'inscription : 26/07/2015
 Re: Tableaux du taux de CO2 en fonction du KH et pH : théorie
Re: Tableaux du taux de CO2 en fonction du KH et pH : théorie
Mar 28 Juil 2015 - 16:23
Bonjour,
N'étant pas expert voici ce que je lis sur la documentation Compte-bulles CO2 Exact de Dennerlé :
- Valeurs idéales se situant entre 20/25 mg/l
- Règle de base commencer par environ 10 bulles/min par 100l d'eau dans l'aquarium
soit dans mon cas 45 bulles/min
Ensuite ce CO2 est injecté dans un "réactor" via un anti retour ....
N'étant pas expert voici ce que je lis sur la documentation Compte-bulles CO2 Exact de Dennerlé :
- Valeurs idéales se situant entre 20/25 mg/l
- Règle de base commencer par environ 10 bulles/min par 100l d'eau dans l'aquarium
soit dans mon cas 45 bulles/min
Ensuite ce CO2 est injecté dans un "réactor" via un anti retour ....
 waliounConseiller
waliounConseiller
 Nombre de messages : 4276
Nombre de messages : 4276
Age : 88
Localisation : 06110 Bassin Cannois
Emploi : retraité
Date d'inscription : 08/08/2012
 Re: Tableaux du taux de CO2 en fonction du KH et pH : théorie
Re: Tableaux du taux de CO2 en fonction du KH et pH : théorie
Mar 28 Juil 2015 - 16:52
Il n'y a aucune contradiction avec ce que j'ai dit, la recommandation est de ne pas dépasser les 25mg/L de co2.
Et comme te l'a dit Ha Dé et moi, tu démarre à ce que tu veut, donc 45 bulles minutes, et tu affine en augmentant ou diminuant pour avoir les 20/25 mg/L
Car en fait c'est l'efficacité du diffuseur, a charger l'eau en Co2, qui déterminera ton réglage.
Et comme te l'a dit Ha Dé et moi, tu démarre à ce que tu veut, donc 45 bulles minutes, et tu affine en augmentant ou diminuant pour avoir les 20/25 mg/L
Car en fait c'est l'efficacité du diffuseur, a charger l'eau en Co2, qui déterminera ton réglage.
_________________
Cordialement
Henri,
Mon Rio 180

Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum

