La méthode des déséquilibres controlés
+5
Cory29
Yann vialle
Stan78
walioun
alexv95
9 participants
Page 1 sur 2 • 1, 2 

 alexv95Spécialiste plantes
alexv95Spécialiste plantes
 Nombre de messages : 3171
Nombre de messages : 3171
Localisation : Val d'Oise
Emploi : Jardinier aquatique
Date d'inscription : 10/11/2012
 La méthode des déséquilibres controlés
La méthode des déséquilibres controlés
Sam 23 Déc 2017 - 11:17
Bonjour à tous,
J'ai découvert récemment la méthode des déséquilibres contrôlés. Il s'agit à la fois d'une méthode de fertilisation pour bac planté et d'une méthode de prévention et de lutte contre les algues. Elle est proposé par Christian Rubilar sur le site APC, en anglais.
Je trouve cette approche très intéressante, j'ai comme probablement beaucoup d'entre vous, eu des problèmes d'algues ou de croissance des plantes aquatiques et cette méthode semble être un bon compromis pour résoudre ces deux problèmes. Même si je n'ai pas encore beaucoup de recul sur sa mise en pratique, les résultats semblent très bons (l'approche fonctionne bien chez moi et les retours des autres utilisateurs sont plus que positifs).
Elle est accessible ici : http://www.aquaticplantcentral.com/forumapc/algae/69737-method-controlled-imbalances-summary.html
Ce que j'aime beaucoup dans cette méthode est qu'elle est basée sur l'observation (assez accessible même pour les débutants), et non sur les tests d'aquariophilie qui de mon point de vue ne sont définitivement pas fiables. Il y a une présentation de la méthode de base puis plusieurs exemples de résolutions de problèmes d'algues. L'auteur indique également les besoins prioritaires de plusieurs espèces de plantes pour favoriser éventuellement la consommation de certains nutriments.
Je vais proposer dans les post suivants une traduction de cette méthode (ça risque de me prendre un peu de temps), je vais verrouiller plusieurs dédiés à cette traduction. N'hésitez pas à me reprendre si je fais des erreurs de traduction ou autre.
Bonne lecture.
J'ai découvert récemment la méthode des déséquilibres contrôlés. Il s'agit à la fois d'une méthode de fertilisation pour bac planté et d'une méthode de prévention et de lutte contre les algues. Elle est proposé par Christian Rubilar sur le site APC, en anglais.
Je trouve cette approche très intéressante, j'ai comme probablement beaucoup d'entre vous, eu des problèmes d'algues ou de croissance des plantes aquatiques et cette méthode semble être un bon compromis pour résoudre ces deux problèmes. Même si je n'ai pas encore beaucoup de recul sur sa mise en pratique, les résultats semblent très bons (l'approche fonctionne bien chez moi et les retours des autres utilisateurs sont plus que positifs).
Elle est accessible ici : http://www.aquaticplantcentral.com/forumapc/algae/69737-method-controlled-imbalances-summary.html
Ce que j'aime beaucoup dans cette méthode est qu'elle est basée sur l'observation (assez accessible même pour les débutants), et non sur les tests d'aquariophilie qui de mon point de vue ne sont définitivement pas fiables. Il y a une présentation de la méthode de base puis plusieurs exemples de résolutions de problèmes d'algues. L'auteur indique également les besoins prioritaires de plusieurs espèces de plantes pour favoriser éventuellement la consommation de certains nutriments.
Je vais proposer dans les post suivants une traduction de cette méthode (ça risque de me prendre un peu de temps), je vais verrouiller plusieurs dédiés à cette traduction. N'hésitez pas à me reprendre si je fais des erreurs de traduction ou autre.
Bonne lecture.
 alexv95Spécialiste plantes
alexv95Spécialiste plantes
 Nombre de messages : 3171
Nombre de messages : 3171
Localisation : Val d'Oise
Emploi : Jardinier aquatique
Date d'inscription : 10/11/2012
 Re: La méthode des déséquilibres controlés
Re: La méthode des déséquilibres controlés
Sam 23 Déc 2017 - 11:19
INTRODUCTION À LA FERTILISATION ET AU CONTRÔLE DES ALGUES
LA MÉTHODE DES DÉSÉQUILIBRES CONTRÔLÉS
Par Christian Rubilar
Il existe une relation très étroite entre la fertilisation, la consommation de nutriments et les algues. Le but de ce travail est d'expliquer comment cette relation fonctionne. Même si c'est un sujet complexe avec beaucoup de nouvelles idées, je vais essayer d'être aussi clair que possible.
Les idées que je vais détailler ont été découvertes au cours de mon travail comme "jardinier d'aquarium" et ont été confirmées par des retours positifs au cours des 5 dernières années sur le plus important forum de discussion Espagnol , donc ce n'est pas de la spéculation. La MCI a été lue plus de 100 000 fois depuis sa publication et les algues ne sont plus un problème pour nous.
Je crois que l'un des principaux problèmes concernant les algues est la confusion. En lisant les ouvrages dédiés à cette thématique, nous pouvons constater que de nombreux auteurs affirment que certaines algues prolifèrent à cause d'excès de NO3 ou de PO4. Quand je lis ceci, je comprends que cette personne n'a aucune idée de la raison pour laquelle les algues prolifèrent.
Les méthodes de fertilisation les plus populaires ne tiennent pas suffisamment compte des algues. Certains d'entre elles concentrent leur attention sur le CO2, d'autres affirment que l'atteinte de l'équilibre du bac résoudra le problème. Mais cela n'arrive jamais!
D'un autre côté, la méthode EI (il s'agit de la méthode de Tom Barr mais elle est peu utilisé sur forumaquario) affirme que les algues prolifèrent à cause du manque de CO2, de lumière ou de fertilisation. L'idée est bien orientée, mais incomplète.
Le concept de niveaux de CO2 et de lumière adaptés sont trop basiques, donc je préfère les utiliser comme prérequis.
À propos du manque de nutriments, la méthode EI affirme que les algues prolifèrent à cause d'un carence d'un nutriment et proposent d'ajouter cet élément macro/micro pour résoudre le problème. Je ne suis pas d'accord avec cette approche. Dans les pages suivantes, je vais vous expliquer pourquoi.
INTRODUCTION
A. Contexte
Il y a quelques années, je travaillais avec une entreprise développant un engrais pour aquarium. Quand nous avons eu le prototype prêt, j'ai mis en place 5 aquariums plantés très éclairés et avec de fortes concentrations en CO2 afin de tester différentes combinaisons de surdosage du produit. Je l'ai associé avec du PO4, du KNO3, du Fe, etc. afin de provoquer une prolifération d'algues.
J'ai découvert qu'il existe une relation entre certains déséquilibres et certaines algues. D'un autre côté, lorsque j'ai essayé la solution proposée par la méthode EI et d'autres méthodes, elles n'ont tout simplement pas fonctionné.
Ce test démontre également que lorsque vous ajoutez uniquement du KNO3], la concentration en Po4 devient nulle et les GSA prolifèrent.
(Les GSA sont les Green spot algae ou algues point vert elles ressemblent à ça :

J'ai découvert que dans ces conditions, les autres algues cessent de proliférer ou meurent. Je l'ai appelé le protocole générique KNO3, qui est l'outil principal que nous allons utiliser avec la MCI.
B. Qu'est-ce que la MCI?
La MCI est avant tout une méthode de contrôle des algues.
J'ai découvert que lorsque le Co2 et la Lumière sont assez élevés et que vous avez un problème d'algue, cela est lié à un déséquilibre entre les nutriments après absorption.
Il y a des relations très étroites entre ces nutriments et il est facile de résoudre n'importe quel problème d'algue quand vous comprenez comment ils fonctionnent. J'utilise le terme déséquilibre car les termes excès ou manque sont incomplets. Lorsque vous utilisez les termes excès ou manque, vous parlez d'un macro / micro nutriment sans aucune relation avec les autres nutriments.
La vieille école affirme que les algues prolifèrent en raison d'un excès de nutriments, principalement les PO4. La méthode EI affirme que le manque d'éléments nutritifs est la cause des algues. Aucun d'entre eux n'a complètement tord. Parfois il s'agit d'un manque, d'autres fois est d'un excès, cela dépend.
La combinaison de macros / micros nutriments que nous préparons dans la bouteille de fertilisation est peu importante, la chose la plus importante est ce qui est consommé par les plantes et ce qui reste dans l'eau.
L'approche de la MCI sur la partie fertilisation utilise les algues pour déterminer la consommation des plantes et propose de développer une fertilisation personnalisée pour chaque aquarium.
Il est impossible de standardiser un régime de fertilisation. La lumière et le CO2 sont surestimés, la principale variable est la combinaison de plantes dans le bac. Il existe ceratines plantes ayant une consommation prioritaire de PO4, NO3, Fe, Ca, etc. mais la plupart d'entre elles n'ont aucun besoin spécial.
Par exemple, la glossostigma elatinoides consomme en priorité du NO3. Cela signifie que si vous n'ajoutez pas suffisamment de KNO3, vous aurez probablement des problèmes avec les cyanobactéries. Si vous avez un gazon de marsilea crenata et que vous n'ajoutez pas assez de PO4, vous aurez des problèmes avec GSA. Les anubias et les microsorums sont aussi des plantes consommant en priorité des PO4.
L'idée derrière la MCI est que si nous avons assez de CO2 et de lumière nous pouvons utiliser les plantes comme filtre et induire des changements dans la composition de l'eau qui nous aide à avoir un aquarium sans algue tout en conservant une croissance rapide/appropritée des plantes. Dans certains cas, par exemple pour un aquarium avec des discus, nous devrions choisir des plantes consommant en priorité des PO4 comme marsilea crenata afin de rechercher un équilibre sur le long terme.
La MCI commence par l'ajout de KNO3, d'un faible taux de Fe (0,1 ppm) et sans ajout de PO4 et de sulfate de potassium. Mais ce n'est qu'un début, les algues vous diront si vous avez besoin d'ajouter des PO4 et en quelle quantité. Je l'expliquerai en détail plus tard.
Si vous venez de la méthode PPS ou EI, avant de commencer à utiliser la MCI, vous devrez diminuer les concentrations en PO4 et en Fe dans votre eau , sinon le protocole générique de KNO3 prendra plusieurs semaines pour atteindre une concentration nulle en PO4 et les plantes souffriront beaucoup du manque de micros / Fe, etc.
C. Méthodologie
La méthode que je propose ne fonctionne que dans certaines conditions de lumière / eau / plantes / CO2, que je vais expliquer en détail.
Même lorsque vous recherchez des informations sur les algues, vous pouvez trouver beaucoup de causes possibles pour chacune d'entre elles (flux de circulation d'eau trop important, excès de lumière, etc.), je vais me concentrer sur la variable clé, celui qui résout le problème en le modifiant.
Parfois, le problème vient de la composition de l'eau du robinet. Pour cette raison, je vais consacrer un chapitre pour expliquer les problèmes les plus courants.
Il est très important de ne pas mélanger les méthodes et il convient d'oublier tout ce que vous savez. J'ai découvert que certaines de nos connaissances sont incomplètes, erronées ou proviennent simplement d'une mauvaise interprétation de faits, expériences ou études.
Je crois que le malentendu à propos des algues est lié à l'utilisation des connaissances de la culture hydroponique et terrestre des plantes. Les algues n'existent pas hors de l'eau, il n'est pas nécessaire d'y penser. Les plantes sont assez flexibles concernant leur consommation. Peu importe la méthode de fertilisation que vous avez choisie, elles seront généralement adapté à la culture des plantes. Cependant, les algues pourront apparaître et la mauvaise théorie est généralement responsable.
Par exemple, le rapport populaire Ca:Mg est 4:1. Il s'agit d'un rapport issu d'études terrestres. Sous l'eau, ce rapport entraine plusieurs problèmes d'algues. Le ratio qui fonctionne le mieux est exactement le contraire 1:4.
Le potassium (K) pose également un problème. Le K est, sans doute nécessaire, mais l'excès n'est pas profitable en milieu aquatique. Si vous ajoutez trop de K, le NO3 peut atteindre zéro et vous aurez des ennuis.
Mon idée de base est de découvrir les règles des milieux aquatiques, elles sont généralement différentes, donc, toutes les «connaissances scientifiques» hors milieu aquatique deviennent inutiles, problématiques ou ouvertes au débat. Tout principe scientifique peut être remis en question. J'ai testé par moi-même les règles que vous connaissez d'autres méthodes, j'en ai confirmé certaines, j'en ai réfuté beaucoup. Parfois, avec les mêmes faits, j'ai eu une interprétation différente qui fonctionne mieux. Mais je ne me suis jamais entêté sur un principe qui ne fonctionne pas. Un principe qui ne fonctionne pas devrait être abandonné car c'est une mauvaise théorie.
II. LA MÉTHODE DES DÉSÉQUILIBRES CONTRÔLÉS
Lorsque l'équilibre est atteint dans un aquarium, les plantes poussent correctement et vous n'avez pas d'algues. Vous pouvez atteindre cet objectif avec n'importe quelle méthode de fertilisation.
Malheureusement, nous faisons face à un équilibre dynamique qui implique de nombreux facteurs sur lesquels nous avons plus d'incertitudes que de certitudes. En ce sens, je pense que la meilleure façon de comprendre notre situation est d'avoir une analogie: un homme aveugle qui monte sur le trottoir avec sa canne. S'il traverse pour la première fois, il y a peu de choses qu'il peut prédire à coup sûr. L'aveugle sait que la rue est à sa droite et que le mur est à sa gauche. Mais le fait est qu'il n'a aucune idée de la hauteur du bâtiment et essayer de le découvrir n'aurait pas de sens . En pratique, cette personne pourra tâtonner le sol avec sa canne jusqu'à ce qu'il trouve le mur sur sa gauche et de là il pourra commencer à marcher et atteindre sa destination sans se perdre car même s'il ne voit pas, il pourra utiliser le mur comme une ligne directrice.
Dans l'aquarium nous avons toute une série de variables dynamiques que nous ne connaissons pas mais, en tant qu'aveugle, nous pouvons choisir entre le mur et la rue. À mon avis, et c'est strictement arbitraire, le mur et la sécurité sont les GSA.
Ainsi, notre cible en utilisant la «méthode des déséquilibres contrôlés» ne sera pas d'avoir des GSA mais, au contraire, de générer un équilibre dynamique dans lequel nous pouvons prédire un déséquilibre que nous pourrions avoir. L'idée est de générer une chimie de l'eau proche de l'apparition de GSA car la correction est aussi simple que sûre pour la santé et l'esthétique de notre aquarium.
Même cette idée peut sembler un peu étrange pour vous, le fait est que toutes les méthodes de fertilisation oriente mais une certaine chimie de l'eau, mais ils ne s'en rendent pas compte. La méthode EI, par exemple, a une tendance au développement de GDA, un déséquilibre lié à un mauvais rapport Ca: Mg avec trop de PO4.
GDA = green dust algae, je ne connais pas le nom en Français, si quelqu'un veut bien compléter, c'est cette algue :

Cependant, que se passe-t-il en cas de déséquilibre inattendu et autres proliférations d'algues?
Il y a des réponses possibles. Chercher à rétablir l'équilibre immédiatement ne fonctionne pas.
Augmenter la fertilisation non plus, seulement parfois.
En suivant l'analogie de l'aveugle, nous devrions chercher l'apparition de GSA puisque lorsqu'elles sont présentes, nous savons où nous sommes de la même manière que l'aveugle trouve le mur avec sa canne. Une chimie de l'eau favorable aux GSA est un désert pour d'autres algues et les GSA sont faciles à enlever en ajoutant une petite quantité quotidienne de PO4 (protocole PO4).
Les avantages de cette approche méthodologique sont multiples. Tout d'abord, comme les aveugles tâtonnant le mur, le nombre de variables en jeu est infini mais celles sur lesquelles nous travaillons sont extrêmement limitées ce qui nous permet d'interagir facilement avec elles.
LA MÉTHODE DES DÉSÉQUILIBRES CONTRÔLÉS
Par Christian Rubilar
Il existe une relation très étroite entre la fertilisation, la consommation de nutriments et les algues. Le but de ce travail est d'expliquer comment cette relation fonctionne. Même si c'est un sujet complexe avec beaucoup de nouvelles idées, je vais essayer d'être aussi clair que possible.
Les idées que je vais détailler ont été découvertes au cours de mon travail comme "jardinier d'aquarium" et ont été confirmées par des retours positifs au cours des 5 dernières années sur le plus important forum de discussion Espagnol , donc ce n'est pas de la spéculation. La MCI a été lue plus de 100 000 fois depuis sa publication et les algues ne sont plus un problème pour nous.
Je crois que l'un des principaux problèmes concernant les algues est la confusion. En lisant les ouvrages dédiés à cette thématique, nous pouvons constater que de nombreux auteurs affirment que certaines algues prolifèrent à cause d'excès de NO3 ou de PO4. Quand je lis ceci, je comprends que cette personne n'a aucune idée de la raison pour laquelle les algues prolifèrent.
Les méthodes de fertilisation les plus populaires ne tiennent pas suffisamment compte des algues. Certains d'entre elles concentrent leur attention sur le CO2, d'autres affirment que l'atteinte de l'équilibre du bac résoudra le problème. Mais cela n'arrive jamais!
D'un autre côté, la méthode EI (il s'agit de la méthode de Tom Barr mais elle est peu utilisé sur forumaquario) affirme que les algues prolifèrent à cause du manque de CO2, de lumière ou de fertilisation. L'idée est bien orientée, mais incomplète.
Le concept de niveaux de CO2 et de lumière adaptés sont trop basiques, donc je préfère les utiliser comme prérequis.
À propos du manque de nutriments, la méthode EI affirme que les algues prolifèrent à cause d'un carence d'un nutriment et proposent d'ajouter cet élément macro/micro pour résoudre le problème. Je ne suis pas d'accord avec cette approche. Dans les pages suivantes, je vais vous expliquer pourquoi.
INTRODUCTION
A. Contexte
Il y a quelques années, je travaillais avec une entreprise développant un engrais pour aquarium. Quand nous avons eu le prototype prêt, j'ai mis en place 5 aquariums plantés très éclairés et avec de fortes concentrations en CO2 afin de tester différentes combinaisons de surdosage du produit. Je l'ai associé avec du PO4, du KNO3, du Fe, etc. afin de provoquer une prolifération d'algues.
J'ai découvert qu'il existe une relation entre certains déséquilibres et certaines algues. D'un autre côté, lorsque j'ai essayé la solution proposée par la méthode EI et d'autres méthodes, elles n'ont tout simplement pas fonctionné.
Ce test démontre également que lorsque vous ajoutez uniquement du KNO3], la concentration en Po4 devient nulle et les GSA prolifèrent.
(Les GSA sont les Green spot algae ou algues point vert elles ressemblent à ça :

J'ai découvert que dans ces conditions, les autres algues cessent de proliférer ou meurent. Je l'ai appelé le protocole générique KNO3, qui est l'outil principal que nous allons utiliser avec la MCI.
B. Qu'est-ce que la MCI?
La MCI est avant tout une méthode de contrôle des algues.
J'ai découvert que lorsque le Co2 et la Lumière sont assez élevés et que vous avez un problème d'algue, cela est lié à un déséquilibre entre les nutriments après absorption.
Il y a des relations très étroites entre ces nutriments et il est facile de résoudre n'importe quel problème d'algue quand vous comprenez comment ils fonctionnent. J'utilise le terme déséquilibre car les termes excès ou manque sont incomplets. Lorsque vous utilisez les termes excès ou manque, vous parlez d'un macro / micro nutriment sans aucune relation avec les autres nutriments.
La vieille école affirme que les algues prolifèrent en raison d'un excès de nutriments, principalement les PO4. La méthode EI affirme que le manque d'éléments nutritifs est la cause des algues. Aucun d'entre eux n'a complètement tord. Parfois il s'agit d'un manque, d'autres fois est d'un excès, cela dépend.
La combinaison de macros / micros nutriments que nous préparons dans la bouteille de fertilisation est peu importante, la chose la plus importante est ce qui est consommé par les plantes et ce qui reste dans l'eau.
L'approche de la MCI sur la partie fertilisation utilise les algues pour déterminer la consommation des plantes et propose de développer une fertilisation personnalisée pour chaque aquarium.
Il est impossible de standardiser un régime de fertilisation. La lumière et le CO2 sont surestimés, la principale variable est la combinaison de plantes dans le bac. Il existe ceratines plantes ayant une consommation prioritaire de PO4, NO3, Fe, Ca, etc. mais la plupart d'entre elles n'ont aucun besoin spécial.
Par exemple, la glossostigma elatinoides consomme en priorité du NO3. Cela signifie que si vous n'ajoutez pas suffisamment de KNO3, vous aurez probablement des problèmes avec les cyanobactéries. Si vous avez un gazon de marsilea crenata et que vous n'ajoutez pas assez de PO4, vous aurez des problèmes avec GSA. Les anubias et les microsorums sont aussi des plantes consommant en priorité des PO4.
L'idée derrière la MCI est que si nous avons assez de CO2 et de lumière nous pouvons utiliser les plantes comme filtre et induire des changements dans la composition de l'eau qui nous aide à avoir un aquarium sans algue tout en conservant une croissance rapide/appropritée des plantes. Dans certains cas, par exemple pour un aquarium avec des discus, nous devrions choisir des plantes consommant en priorité des PO4 comme marsilea crenata afin de rechercher un équilibre sur le long terme.
La MCI commence par l'ajout de KNO3, d'un faible taux de Fe (0,1 ppm) et sans ajout de PO4 et de sulfate de potassium. Mais ce n'est qu'un début, les algues vous diront si vous avez besoin d'ajouter des PO4 et en quelle quantité. Je l'expliquerai en détail plus tard.
Si vous venez de la méthode PPS ou EI, avant de commencer à utiliser la MCI, vous devrez diminuer les concentrations en PO4 et en Fe dans votre eau , sinon le protocole générique de KNO3 prendra plusieurs semaines pour atteindre une concentration nulle en PO4 et les plantes souffriront beaucoup du manque de micros / Fe, etc.
C. Méthodologie
La méthode que je propose ne fonctionne que dans certaines conditions de lumière / eau / plantes / CO2, que je vais expliquer en détail.
Même lorsque vous recherchez des informations sur les algues, vous pouvez trouver beaucoup de causes possibles pour chacune d'entre elles (flux de circulation d'eau trop important, excès de lumière, etc.), je vais me concentrer sur la variable clé, celui qui résout le problème en le modifiant.
Parfois, le problème vient de la composition de l'eau du robinet. Pour cette raison, je vais consacrer un chapitre pour expliquer les problèmes les plus courants.
Il est très important de ne pas mélanger les méthodes et il convient d'oublier tout ce que vous savez. J'ai découvert que certaines de nos connaissances sont incomplètes, erronées ou proviennent simplement d'une mauvaise interprétation de faits, expériences ou études.
Je crois que le malentendu à propos des algues est lié à l'utilisation des connaissances de la culture hydroponique et terrestre des plantes. Les algues n'existent pas hors de l'eau, il n'est pas nécessaire d'y penser. Les plantes sont assez flexibles concernant leur consommation. Peu importe la méthode de fertilisation que vous avez choisie, elles seront généralement adapté à la culture des plantes. Cependant, les algues pourront apparaître et la mauvaise théorie est généralement responsable.
Par exemple, le rapport populaire Ca:Mg est 4:1. Il s'agit d'un rapport issu d'études terrestres. Sous l'eau, ce rapport entraine plusieurs problèmes d'algues. Le ratio qui fonctionne le mieux est exactement le contraire 1:4.
Le potassium (K) pose également un problème. Le K est, sans doute nécessaire, mais l'excès n'est pas profitable en milieu aquatique. Si vous ajoutez trop de K, le NO3 peut atteindre zéro et vous aurez des ennuis.
Mon idée de base est de découvrir les règles des milieux aquatiques, elles sont généralement différentes, donc, toutes les «connaissances scientifiques» hors milieu aquatique deviennent inutiles, problématiques ou ouvertes au débat. Tout principe scientifique peut être remis en question. J'ai testé par moi-même les règles que vous connaissez d'autres méthodes, j'en ai confirmé certaines, j'en ai réfuté beaucoup. Parfois, avec les mêmes faits, j'ai eu une interprétation différente qui fonctionne mieux. Mais je ne me suis jamais entêté sur un principe qui ne fonctionne pas. Un principe qui ne fonctionne pas devrait être abandonné car c'est une mauvaise théorie.
II. LA MÉTHODE DES DÉSÉQUILIBRES CONTRÔLÉS
Lorsque l'équilibre est atteint dans un aquarium, les plantes poussent correctement et vous n'avez pas d'algues. Vous pouvez atteindre cet objectif avec n'importe quelle méthode de fertilisation.
Malheureusement, nous faisons face à un équilibre dynamique qui implique de nombreux facteurs sur lesquels nous avons plus d'incertitudes que de certitudes. En ce sens, je pense que la meilleure façon de comprendre notre situation est d'avoir une analogie: un homme aveugle qui monte sur le trottoir avec sa canne. S'il traverse pour la première fois, il y a peu de choses qu'il peut prédire à coup sûr. L'aveugle sait que la rue est à sa droite et que le mur est à sa gauche. Mais le fait est qu'il n'a aucune idée de la hauteur du bâtiment et essayer de le découvrir n'aurait pas de sens . En pratique, cette personne pourra tâtonner le sol avec sa canne jusqu'à ce qu'il trouve le mur sur sa gauche et de là il pourra commencer à marcher et atteindre sa destination sans se perdre car même s'il ne voit pas, il pourra utiliser le mur comme une ligne directrice.
Dans l'aquarium nous avons toute une série de variables dynamiques que nous ne connaissons pas mais, en tant qu'aveugle, nous pouvons choisir entre le mur et la rue. À mon avis, et c'est strictement arbitraire, le mur et la sécurité sont les GSA.
Ainsi, notre cible en utilisant la «méthode des déséquilibres contrôlés» ne sera pas d'avoir des GSA mais, au contraire, de générer un équilibre dynamique dans lequel nous pouvons prédire un déséquilibre que nous pourrions avoir. L'idée est de générer une chimie de l'eau proche de l'apparition de GSA car la correction est aussi simple que sûre pour la santé et l'esthétique de notre aquarium.
Même cette idée peut sembler un peu étrange pour vous, le fait est que toutes les méthodes de fertilisation oriente mais une certaine chimie de l'eau, mais ils ne s'en rendent pas compte. La méthode EI, par exemple, a une tendance au développement de GDA, un déséquilibre lié à un mauvais rapport Ca: Mg avec trop de PO4.
GDA = green dust algae, je ne connais pas le nom en Français, si quelqu'un veut bien compléter, c'est cette algue :

Cependant, que se passe-t-il en cas de déséquilibre inattendu et autres proliférations d'algues?
Il y a des réponses possibles. Chercher à rétablir l'équilibre immédiatement ne fonctionne pas.
Augmenter la fertilisation non plus, seulement parfois.
En suivant l'analogie de l'aveugle, nous devrions chercher l'apparition de GSA puisque lorsqu'elles sont présentes, nous savons où nous sommes de la même manière que l'aveugle trouve le mur avec sa canne. Une chimie de l'eau favorable aux GSA est un désert pour d'autres algues et les GSA sont faciles à enlever en ajoutant une petite quantité quotidienne de PO4 (protocole PO4).
Les avantages de cette approche méthodologique sont multiples. Tout d'abord, comme les aveugles tâtonnant le mur, le nombre de variables en jeu est infini mais celles sur lesquelles nous travaillons sont extrêmement limitées ce qui nous permet d'interagir facilement avec elles.
N.Master aime ce message
 alexv95Spécialiste plantes
alexv95Spécialiste plantes
 Nombre de messages : 3171
Nombre de messages : 3171
Localisation : Val d'Oise
Emploi : Jardinier aquatique
Date d'inscription : 10/11/2012
 Re: La méthode des déséquilibres controlés
Re: La méthode des déséquilibres controlés
Sam 23 Déc 2017 - 11:20
III. PRÉREQUIS
La MDC utilise les plantes comme catalyseur pour presque n'importe quel déséquilibre qui se produit dans l'aquarium. Comme il y a de nombreuses variables impliquées, allant de la qualité de l'eau, les combinaisons de plantes, poissons, lumière, entre autres, je vais essayer de standardiser certaines exigences de base sans lesquelles il devient difficile de maintenir un aquarium sain.
En ce sens, cette méthode suppose une lumière d'au moins 4 watts par gallon (environ 1 W/L), un taux de CO2 entre 25 et 35 ppm et qu'il y ait suffisamment de plantes à croissance rapide (avec uniquement des Echinodorus ce système ne fonctionne pas).
1. Éclairage. Généralités
Quand je propose d'utiliser la règle du gallon / watts, nous sommes aussi imprécis que clair. Il y a beaucoup d'autres façons de calculer le niveau d'éclairage, les lummens, les pars, etc. Je crois que la «précision» à propos de la lumière n'est qu'une illusion. Il y a trop de variables en jeu et le sujet devient trop difficile à comprendre.
Pour cette raison, je propose de conserver la règle gallons / watts avec quelques modifications pour plus de précision sans perdre en clarté.
Dans l'ensemble, on dit que les plantes ont besoin d'au moins 2 watts/g (0,5 W/L) et, en fait, cela devrait être considéré comme le strict minimum pour la survie et la pousse des plantes "faciles". Cependant, notre objectif est un peu plus ambitieux car je veux induire un métabolisme à 100%, c'est pourquoi nous recommandons au minimum 4 watts/g (1 W/L). Cependant, les retours des deux dernières années ont montré que de nombreuses personnes ont utilisé ce système avec succès avec des aquariums moins éclairés (jusqu'à 0,3 watt/g, soit 0,08 W/L). Quoi qu'il en soit, nous recommandons d'améliorer l'éclairage.
Comme évoqué précédemment, cette règle comportent quelques corrections simples:
1) La règle watt / g ne fonctionne que dans les aquariums jusqu'à 18 pouces (45 cm) de hauteur. Il s'agit d'une hauteur brute (hauteur du bac à vide) et non la hauteur nette (hauteur de la colonne d'eau). Les tubes néon ont une faible pénétration dans l'eau, si nous n'utilisons pas cette correction, nous pouvons faire l'erreur de croire avoir la lumière appropriée avec un aquarium profond. Dans le cas de bacs profonds, nous recommandons l'utilisation de HQI.
2) À l'avant de l'aquarium, vous devez utiliser un éclairage de type PLLS (si je ne me trompe pas ce sont les Fluo Compacts) afin de fournir la lumière appropriée les plantes gazonnantes comme glossostigma elatinoides, echinodorus tenellus, etc. L'avantage de l'éclairage PLL est que vous avez deux ou trois fois plus de lumière dans le même espace .
3) La troisième correction concerne la qualité de la lumière. Nous recommandons généralement d'utiliser, de l'arrière vers l'avant des tubes grolux, 842 et 954. Les plantes gazonnantes (glosso, HC, etc.) sont plus sensibles à la quantité qu'à la qualité de la lumière. Pour cette raison, vous pouvez utiliser des tubes 865 au lieu des 954 ou HQI.
2. Qualité de l'eau
Initialement, ce chapitre n’était pas présent dans la MCI mais suite aux retours faits sur la méthode, il était nécessaire de l’ajouter. Je n’avais pas sous-estimé son importance mais j'étais conscient de l'énorme diversité de composition chimique des eaux à travers le monde et j'avais préféré ne pas généraliser. Le retour d'expérience m'a permis d'identifier des cas problématiques que je décrirai brièvement dans ce chapitre.
a. L'un des problèmes les plus fréquents est lié à la surpopulation. L'excès de poisson, de crevettes ou de mélanoïdes peut produire suffisamment d'ammoniaque pour entrainer une prolifération de GSA (Green String Algae, il s’agit de cette algue, une variété d’algue filamenteuse :
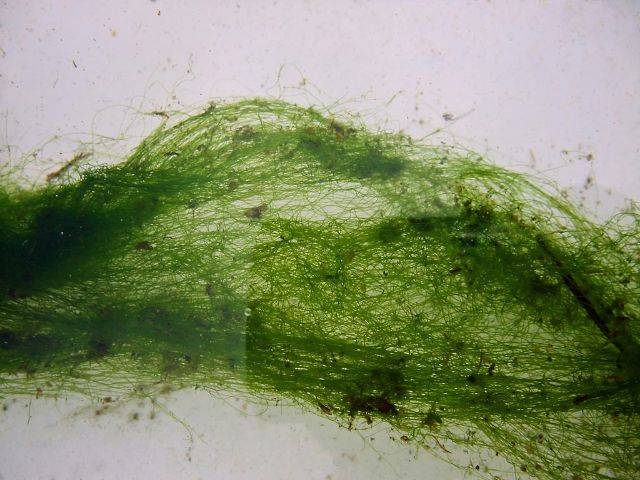
Dans ce cas, les résultats des tests peuvent être négatifs à tort, ils ne sont pas fiables car ils ne mesurent que l'ammoniaque non absorbé par les algues.
Réduire la population est essentiel. Parfois, l'augmentation de la filtration biologique peut aider sur le long terme.
L'utilisation de la zéolite est la meilleure option. Elle est habituellement commercialisée comme support « anti-ammoniaque », à ajouter aux masses filtrantes. Il existe d'autres produits qui produisent le même effet.
b. A partir des retours faits sur la méthode et de ma propre expérience lorsque j'étais à Annapolis, j'ai découvert que l'ammoniaque était généralement apportée par l'eau du robinet. Tester l'eau du robinet avant chaque changement d'eau est une bonne idée lorsque l'aquarium est encore "jeune" et peu pourvu en plantes.
c. Dans certains endroits, l'eau du robinet est dure, avec un déséquilibre lié au carbonate de calcium (CaCO3). Barcelone en fait partie, Brooklyn également. Dans ce cas, nous allons faire face à deux problèmes. Un KH élevé interfère avec la dissolution du CO2. Et un excès de Ca créé un environnement favorable à la prolifération d’une variété spécifique d’algues rouges (voir le chapitre sur les algues).
Une solution évidente consiste à mélanger 50% d’eau osmosée ou distillée avec 50% d'eau du robinet lors des changements d'eau.
d. La pollution est un problème et cela ne va pas s'améliorer. De nombreuses régions du Mexique, du Brésil et de l'état de Buenos Aires (Argentine) ont des problèmes avec des concentrations de NO3 supérieurs à 45 ppm dans l'eau du robinet. Une eau de bonne qualité ne devrait pas dépasser les 10 ppm de NO3.
Si votre eau a ce problème, il existe différentes options.
Le plus évident est d'utiliser de l'eau osmosée.
Une deuxième option consiste à utiliser de l'eau de pluie et à la mélanger avec de l'eau du robinet.
Une troisième option, si vous avez assez d'espace, est d'avoir une réserve d'eau avec un pothos (Epipremnum aureum) émergé.
La MCI est basée sur l'utilisation de KNO3. Dans les cas précédemment cités, nous ne pouvons pas l’utiliser.
Le sulfate de potassium, le carbonate ou bicarbonate de potassium sont des alternatives possibles.
Mais il faudra oublier les recommandations habituelles concernant les quantités à jouter.
Si l'utilisation de KNO3 uniquement permet d’avoir un bac équilibré, alors nous devrions utiliser la règle pragmatique suivante : le rapport NPK dans le KNO3 est respectivement de 1/0/0,5. Donc avec une concentration en NO3 de 40 ppm, nous devrons ajouter la moitié de cette quantité de K, soit 20 ppm.
e. L'eau du robinet peut également contenir un excès de PO4. Ces derniers peuvent provenir des polyphosphates qui sont ajoutés pour protéger les filtres lors du traitement de l’eau, si l’eau traitée est de l’eau de mer ou contient naturellement à faible concentrations une substance toxique comme l'arsenic. C'est le cas de l'eau du robinet à New York, elle contient 3 ppm de PO4.
La meilleur solution est l’utilisation d'eau osmosée.
Même cette eau peut être complexe à utiliser, si vous choisissez correctement vos plantes, vous aurez facilement un aquarium stable. Si vous avez un tapie de marsilea crenata et de l'eau du robinet avec 3 ppm de PO4, alors vous aurez probablement assez de PO4 pour les nourrir. Si des GSA apparaissent, alors vous devrez ajouter un peu de PO4 supplémentaires, comme expliqué dans le chapitre sur la fertilisation. J'avais un aquarium avec un tapie de marsilea crenata et elles absorbaient 4 à 5 ppm de PO4 par semaine.
Anubias, microsorums et cryptos sont également un bon choix.
f. Parfois, l'eau peut être à l’origine de complications. Vous pouvez avoir un déséquilibre lié au Ca et au PO4 en même temps. L’eau de la ville de New-York est comme cela. Les GDA risquent de se développer et la théorie de la méthode EI à ce sujet ne fonctionne tout simplement pas. Je vais expliquer dans le chapitre sur le contrôle des algues comment résoudre ce problème.
g. Parfois l'eau du robinet est trop chargée en soufre. Dans ce cas, si vous ajoutez du sulfate de potassium, vous aurez des soucis avec certaines algues. L'utilisation de 50% d'eau osmosée et de KNO3 à la place du sulfate de potassium résoudront le problème.
h. J'ai lu il y a quelque temps sur le New-York Times que l'eau du robinet de certains états peut contenir plus de 60 000 substances chimiques polluantes, alors que la législation encadre uniquement les problèmes les plus courants comme les excès de NO3. Ainsi, un osmoseur est un bon investissement, pas seulement pour vos poissons et vos plantes.
3. CO2
Il n'est pas nécessaire de justifier de l'importance du CO2, donc je ne traiterai que les sujets problématiques.
Il existe des diagrammes/tableaux pour déterminer le niveau de CO2 dans l'eau à l'aide du pH et du KH. La méthode PPS recommande leur utilisation. C'est une erreur. La précision est si faible que ces tableaux sont inutiles, et sont même des obstacles. Mon expérience personnelle m'a montré que ces tableaux sont utiles uniquement pour les débutants lorsque le manque de CO2 est très important.
En fait, le principal problème avec ce genre de tableaux est que vous pouvez penser que vous avez assez de CO2 alors que ce n'est pas le cas.
Les drop checkers ont le même problème.
Les appareils électroniques ne sont pas magiques, s'ils ne sont pas correctement calibrés, le taux CO2 sera de toute façon bas . Les pH-mètre peuvent être utilisés pour stopper l'injection de CO2. Le moyen le plus simple pour les calibrer est d'utiliser le diagramme pH/KH et c'est une erreur.
J'ai utilisé des tests de CO2 de laboratoire (pas les tests standards d'aquariophilie) et j'ai comparé les résultats obtenus aux diagrammes pH/KH et au comportement des crevettes. D'après le tableau, la concentration en CO2 dans mon bac était de 90 ppm, pourtant les poissons et les crevettes étaient en parfaite santé. Mais le test de CO2 indiquait une concentration de 25 ppm.
Je crois que la meilleure méthode est d'utiliser la crevette comme bio-indicateur. Je propose les crevettes parce qu'elles sont plus sensibles que les poissons. À 40 ppm de CO2, leur comportement change : elles essaient de s'échapper. Donc, la procédure que je propose est de passer une matinée à regarder ce qui se passe dans l'aquarium et toutes les 30 minutes d'augmenter légèrement le CO2 jusqu'à ce que les crevettes se comportent bizarrement. Ensuite, il faut mettre en marche une pompe à air ou tout autre appareil pour oxygéner l'eau ; la quantité de CO2 injectée correspondra au réglage obtenu 30 minutes avant. Il s'agit de la quantité limite en CO2 que vos plantes peuvent absorber sans risque pour vos poissons et vos crevettes.
Si vous avez un aquarium avec des crevettes, alors je vous suggère que lorsque vous atteignez cette limite, vous calibriez le CO2 avec les réglages établis 90 minutes avant et de compenser cet écart par l'ajout de Flourish Excel.
Par exemple, vous ajoutez 1 bulle par seconde, après 30 minutes vous l'augmentez à 2 bulles par seconde et ainsi de suite. Lorsque vous ajoutez 4 bulles par seconde, la crevette se comporte bizarrement. Ensuite, vous oxygènerez l'eau et calibrerez le CO2 à 3 bulles par seconde.
Si vous utilisez un pH-mètre, vous calibrerez le pH un peu plus haut que la valeur relevée lors du calibrage.
Cependant, il y a un risque d'erreur. Si vous avez des discus et que ces derniers ont des parasites dans leurs branchies, ils iront respirer en surface même avec de faibles niveaux de CO2. Les dégâts que ces parasites produisent dans leurs branchies sont irréversibles mais vous pouvez les soigner afin d'éviter que cela empire.
Quelques conseils suite aux commentaires reçus :
- La distribution du CO2 est aussi importante que sa dissolution dans l'eau.
- Les diffuseurs de CO2 de type pipe (avec membrane en céramique) doivent être complétés par une petite pompe de brassage pour distribuer les micro-bulles.
- Le CO2 devrait passer par l'hélice de la pompe de brassage plutôt que par le venturi.
- Les diffuseurs de CO2 de type pipe fonctionne généralement mieux dans les petits aquariums.
- Si votre aquarium nano est trop étroit pour avoir une petite pompe de brassage, il convient de modifier la configuration afin de réduire le débit (il manque l'image d'illustration sur le site qui n'est plus accessible).
Dans les bacs de taille moyenne et grande, nous devrions utiliser un système comme celui-ci connecté à une pompe de brassage de 1900 litres/h (il manque également l'image d'illustration).
4. LES CHANGEMENTS D'EAU
Changer 50% de l'eau du bac chaque semaine permets d'éviter l'apparition les algues.
La MDC utilise les plantes comme catalyseur pour presque n'importe quel déséquilibre qui se produit dans l'aquarium. Comme il y a de nombreuses variables impliquées, allant de la qualité de l'eau, les combinaisons de plantes, poissons, lumière, entre autres, je vais essayer de standardiser certaines exigences de base sans lesquelles il devient difficile de maintenir un aquarium sain.
En ce sens, cette méthode suppose une lumière d'au moins 4 watts par gallon (environ 1 W/L), un taux de CO2 entre 25 et 35 ppm et qu'il y ait suffisamment de plantes à croissance rapide (avec uniquement des Echinodorus ce système ne fonctionne pas).
1. Éclairage. Généralités
Quand je propose d'utiliser la règle du gallon / watts, nous sommes aussi imprécis que clair. Il y a beaucoup d'autres façons de calculer le niveau d'éclairage, les lummens, les pars, etc. Je crois que la «précision» à propos de la lumière n'est qu'une illusion. Il y a trop de variables en jeu et le sujet devient trop difficile à comprendre.
Pour cette raison, je propose de conserver la règle gallons / watts avec quelques modifications pour plus de précision sans perdre en clarté.
Dans l'ensemble, on dit que les plantes ont besoin d'au moins 2 watts/g (0,5 W/L) et, en fait, cela devrait être considéré comme le strict minimum pour la survie et la pousse des plantes "faciles". Cependant, notre objectif est un peu plus ambitieux car je veux induire un métabolisme à 100%, c'est pourquoi nous recommandons au minimum 4 watts/g (1 W/L). Cependant, les retours des deux dernières années ont montré que de nombreuses personnes ont utilisé ce système avec succès avec des aquariums moins éclairés (jusqu'à 0,3 watt/g, soit 0,08 W/L). Quoi qu'il en soit, nous recommandons d'améliorer l'éclairage.
Comme évoqué précédemment, cette règle comportent quelques corrections simples:
1) La règle watt / g ne fonctionne que dans les aquariums jusqu'à 18 pouces (45 cm) de hauteur. Il s'agit d'une hauteur brute (hauteur du bac à vide) et non la hauteur nette (hauteur de la colonne d'eau). Les tubes néon ont une faible pénétration dans l'eau, si nous n'utilisons pas cette correction, nous pouvons faire l'erreur de croire avoir la lumière appropriée avec un aquarium profond. Dans le cas de bacs profonds, nous recommandons l'utilisation de HQI.
2) À l'avant de l'aquarium, vous devez utiliser un éclairage de type PLLS (si je ne me trompe pas ce sont les Fluo Compacts) afin de fournir la lumière appropriée les plantes gazonnantes comme glossostigma elatinoides, echinodorus tenellus, etc. L'avantage de l'éclairage PLL est que vous avez deux ou trois fois plus de lumière dans le même espace .
3) La troisième correction concerne la qualité de la lumière. Nous recommandons généralement d'utiliser, de l'arrière vers l'avant des tubes grolux, 842 et 954. Les plantes gazonnantes (glosso, HC, etc.) sont plus sensibles à la quantité qu'à la qualité de la lumière. Pour cette raison, vous pouvez utiliser des tubes 865 au lieu des 954 ou HQI.
2. Qualité de l'eau
Initialement, ce chapitre n’était pas présent dans la MCI mais suite aux retours faits sur la méthode, il était nécessaire de l’ajouter. Je n’avais pas sous-estimé son importance mais j'étais conscient de l'énorme diversité de composition chimique des eaux à travers le monde et j'avais préféré ne pas généraliser. Le retour d'expérience m'a permis d'identifier des cas problématiques que je décrirai brièvement dans ce chapitre.
a. L'un des problèmes les plus fréquents est lié à la surpopulation. L'excès de poisson, de crevettes ou de mélanoïdes peut produire suffisamment d'ammoniaque pour entrainer une prolifération de GSA (Green String Algae, il s’agit de cette algue, une variété d’algue filamenteuse :

Dans ce cas, les résultats des tests peuvent être négatifs à tort, ils ne sont pas fiables car ils ne mesurent que l'ammoniaque non absorbé par les algues.
Réduire la population est essentiel. Parfois, l'augmentation de la filtration biologique peut aider sur le long terme.
L'utilisation de la zéolite est la meilleure option. Elle est habituellement commercialisée comme support « anti-ammoniaque », à ajouter aux masses filtrantes. Il existe d'autres produits qui produisent le même effet.
b. A partir des retours faits sur la méthode et de ma propre expérience lorsque j'étais à Annapolis, j'ai découvert que l'ammoniaque était généralement apportée par l'eau du robinet. Tester l'eau du robinet avant chaque changement d'eau est une bonne idée lorsque l'aquarium est encore "jeune" et peu pourvu en plantes.
c. Dans certains endroits, l'eau du robinet est dure, avec un déséquilibre lié au carbonate de calcium (CaCO3). Barcelone en fait partie, Brooklyn également. Dans ce cas, nous allons faire face à deux problèmes. Un KH élevé interfère avec la dissolution du CO2. Et un excès de Ca créé un environnement favorable à la prolifération d’une variété spécifique d’algues rouges (voir le chapitre sur les algues).
Une solution évidente consiste à mélanger 50% d’eau osmosée ou distillée avec 50% d'eau du robinet lors des changements d'eau.
d. La pollution est un problème et cela ne va pas s'améliorer. De nombreuses régions du Mexique, du Brésil et de l'état de Buenos Aires (Argentine) ont des problèmes avec des concentrations de NO3 supérieurs à 45 ppm dans l'eau du robinet. Une eau de bonne qualité ne devrait pas dépasser les 10 ppm de NO3.
Si votre eau a ce problème, il existe différentes options.
Le plus évident est d'utiliser de l'eau osmosée.
Une deuxième option consiste à utiliser de l'eau de pluie et à la mélanger avec de l'eau du robinet.
Une troisième option, si vous avez assez d'espace, est d'avoir une réserve d'eau avec un pothos (Epipremnum aureum) émergé.
La MCI est basée sur l'utilisation de KNO3. Dans les cas précédemment cités, nous ne pouvons pas l’utiliser.
Le sulfate de potassium, le carbonate ou bicarbonate de potassium sont des alternatives possibles.
Mais il faudra oublier les recommandations habituelles concernant les quantités à jouter.
Si l'utilisation de KNO3 uniquement permet d’avoir un bac équilibré, alors nous devrions utiliser la règle pragmatique suivante : le rapport NPK dans le KNO3 est respectivement de 1/0/0,5. Donc avec une concentration en NO3 de 40 ppm, nous devrons ajouter la moitié de cette quantité de K, soit 20 ppm.
e. L'eau du robinet peut également contenir un excès de PO4. Ces derniers peuvent provenir des polyphosphates qui sont ajoutés pour protéger les filtres lors du traitement de l’eau, si l’eau traitée est de l’eau de mer ou contient naturellement à faible concentrations une substance toxique comme l'arsenic. C'est le cas de l'eau du robinet à New York, elle contient 3 ppm de PO4.
La meilleur solution est l’utilisation d'eau osmosée.
Même cette eau peut être complexe à utiliser, si vous choisissez correctement vos plantes, vous aurez facilement un aquarium stable. Si vous avez un tapie de marsilea crenata et de l'eau du robinet avec 3 ppm de PO4, alors vous aurez probablement assez de PO4 pour les nourrir. Si des GSA apparaissent, alors vous devrez ajouter un peu de PO4 supplémentaires, comme expliqué dans le chapitre sur la fertilisation. J'avais un aquarium avec un tapie de marsilea crenata et elles absorbaient 4 à 5 ppm de PO4 par semaine.
Anubias, microsorums et cryptos sont également un bon choix.
f. Parfois, l'eau peut être à l’origine de complications. Vous pouvez avoir un déséquilibre lié au Ca et au PO4 en même temps. L’eau de la ville de New-York est comme cela. Les GDA risquent de se développer et la théorie de la méthode EI à ce sujet ne fonctionne tout simplement pas. Je vais expliquer dans le chapitre sur le contrôle des algues comment résoudre ce problème.
g. Parfois l'eau du robinet est trop chargée en soufre. Dans ce cas, si vous ajoutez du sulfate de potassium, vous aurez des soucis avec certaines algues. L'utilisation de 50% d'eau osmosée et de KNO3 à la place du sulfate de potassium résoudront le problème.
h. J'ai lu il y a quelque temps sur le New-York Times que l'eau du robinet de certains états peut contenir plus de 60 000 substances chimiques polluantes, alors que la législation encadre uniquement les problèmes les plus courants comme les excès de NO3. Ainsi, un osmoseur est un bon investissement, pas seulement pour vos poissons et vos plantes.
3. CO2
Il n'est pas nécessaire de justifier de l'importance du CO2, donc je ne traiterai que les sujets problématiques.
Il existe des diagrammes/tableaux pour déterminer le niveau de CO2 dans l'eau à l'aide du pH et du KH. La méthode PPS recommande leur utilisation. C'est une erreur. La précision est si faible que ces tableaux sont inutiles, et sont même des obstacles. Mon expérience personnelle m'a montré que ces tableaux sont utiles uniquement pour les débutants lorsque le manque de CO2 est très important.
En fait, le principal problème avec ce genre de tableaux est que vous pouvez penser que vous avez assez de CO2 alors que ce n'est pas le cas.
Les drop checkers ont le même problème.
Les appareils électroniques ne sont pas magiques, s'ils ne sont pas correctement calibrés, le taux CO2 sera de toute façon bas . Les pH-mètre peuvent être utilisés pour stopper l'injection de CO2. Le moyen le plus simple pour les calibrer est d'utiliser le diagramme pH/KH et c'est une erreur.
J'ai utilisé des tests de CO2 de laboratoire (pas les tests standards d'aquariophilie) et j'ai comparé les résultats obtenus aux diagrammes pH/KH et au comportement des crevettes. D'après le tableau, la concentration en CO2 dans mon bac était de 90 ppm, pourtant les poissons et les crevettes étaient en parfaite santé. Mais le test de CO2 indiquait une concentration de 25 ppm.
Je crois que la meilleure méthode est d'utiliser la crevette comme bio-indicateur. Je propose les crevettes parce qu'elles sont plus sensibles que les poissons. À 40 ppm de CO2, leur comportement change : elles essaient de s'échapper. Donc, la procédure que je propose est de passer une matinée à regarder ce qui se passe dans l'aquarium et toutes les 30 minutes d'augmenter légèrement le CO2 jusqu'à ce que les crevettes se comportent bizarrement. Ensuite, il faut mettre en marche une pompe à air ou tout autre appareil pour oxygéner l'eau ; la quantité de CO2 injectée correspondra au réglage obtenu 30 minutes avant. Il s'agit de la quantité limite en CO2 que vos plantes peuvent absorber sans risque pour vos poissons et vos crevettes.
Si vous avez un aquarium avec des crevettes, alors je vous suggère que lorsque vous atteignez cette limite, vous calibriez le CO2 avec les réglages établis 90 minutes avant et de compenser cet écart par l'ajout de Flourish Excel.
Par exemple, vous ajoutez 1 bulle par seconde, après 30 minutes vous l'augmentez à 2 bulles par seconde et ainsi de suite. Lorsque vous ajoutez 4 bulles par seconde, la crevette se comporte bizarrement. Ensuite, vous oxygènerez l'eau et calibrerez le CO2 à 3 bulles par seconde.
Si vous utilisez un pH-mètre, vous calibrerez le pH un peu plus haut que la valeur relevée lors du calibrage.
Cependant, il y a un risque d'erreur. Si vous avez des discus et que ces derniers ont des parasites dans leurs branchies, ils iront respirer en surface même avec de faibles niveaux de CO2. Les dégâts que ces parasites produisent dans leurs branchies sont irréversibles mais vous pouvez les soigner afin d'éviter que cela empire.
Quelques conseils suite aux commentaires reçus :
- La distribution du CO2 est aussi importante que sa dissolution dans l'eau.
- Les diffuseurs de CO2 de type pipe (avec membrane en céramique) doivent être complétés par une petite pompe de brassage pour distribuer les micro-bulles.
- Le CO2 devrait passer par l'hélice de la pompe de brassage plutôt que par le venturi.
- Les diffuseurs de CO2 de type pipe fonctionne généralement mieux dans les petits aquariums.
- Si votre aquarium nano est trop étroit pour avoir une petite pompe de brassage, il convient de modifier la configuration afin de réduire le débit (il manque l'image d'illustration sur le site qui n'est plus accessible).
Dans les bacs de taille moyenne et grande, nous devrions utiliser un système comme celui-ci connecté à une pompe de brassage de 1900 litres/h (il manque également l'image d'illustration).
4. LES CHANGEMENTS D'EAU
Changer 50% de l'eau du bac chaque semaine permets d'éviter l'apparition les algues.
N.Master aime ce message
 alexv95Spécialiste plantes
alexv95Spécialiste plantes
 Nombre de messages : 3171
Nombre de messages : 3171
Localisation : Val d'Oise
Emploi : Jardinier aquatique
Date d'inscription : 10/11/2012
 Re: La méthode des déséquilibres controlés
Re: La méthode des déséquilibres controlés
Sam 23 Déc 2017 - 11:21
IV. La fertilisation selon la MCI
La MCI est une méthode de fertilisation et de contrôle des algues. Même s'il s'agit avant tout d'une méthode de contrôle des algues, son potentiel de fertilisation est aussi évident. D'autres méthodes de fertilisation prétendent simplement que les algues n'existent pas et n'assument aucune responsabilité à leur égard. Je crois que les algues et la fertilisation sont deux faces de la même pièce. Les algues nous donnent des informations sur la façon d'opérer. Si quelque chose ne va pas, elles prolifèrent. Peu importe la méthode de fertilisation que vous pensez utiliser, dès que vous avez de l'expérience, vous développez votre propre méthode, même si vous ne vous en rendez pas compte. Mais parfois il y a des problèmes récurrents que vous ne pouvez pas résoudre, c'est un élément que vous devriez prendre en compte. Parfois, le problème vient de vous, parfois le problème est que vous utilisez une mauvaise théorie. J'entends par mauvaise théorie, une idée qui ne fonctionne pas et qui de ce fait devrait être abandonnée au lieu d'inventer une pseudo explication scientifique quand cela ne fonctionne toujours pas. Les GDA sont le meilleur exemple. Même s'il y a une très belle explication sur le cycle de vie de cette algue, la solution proposée (attendre) est... comment dire ?... la preuve que l'auteur n'a aucune idée sur la façon d'y faire face. Mais ce n'est pas le bon chapitre pour expliquer cela, traitons de la fertilisation.
1. Généralités
A. A propos des micros et du Fe, si vous en ajoutez 3 fois plus que ce que vos plantes consomment, vous aurez des problèmes d'algues rouges, en supposant que votre bac remplit les conditions préalablement décrites.
A propos du chlorure de calcium, même une faible quantité peut brûler les feuilles des microsorum. Pour cette raison, je ne recommande pas de l'utiliser.
La base de la MCI est la fertilisation avec KNO3, mais pas uniquement, c'est juste un point de départ. La dose que je recommande comme point de départ pour les débutants est de 1 gramme pour 50 gallons (190 litres) par semaine. L'idée est de chercher l'absorption réelle de votre bac, nous allons utiliser le protocole générique KNO3 pour cela. Il consiste à ajouter cette dose tous les jours jusqu'à ce que les GSA apparaissent. Ensuite, la quantité de KNO3 que vous avez ajoutée est la quantité hebdomadaire de KNO3 que vous allez utiliser à l'avenir afin d'avoir une chimie de l'eau proche de l'apparition des GSA.
A propos des phosphates, pour démarrer, je recommande de ne pas en apporter pour le moment. Cependant, la dose que je vais utiliser pour le protocole PO4 est de 1 gramme tous les 500 gallons (1900 litres).
A propos du dosage, les balances électroniques sont si peu coûteuses qu'il n'y a aucune excuse pour ne pas en acheter une.
b. Clarification préliminaire
Lorsque nous parlons de dose hebdomadaire, les apports devraient être faits quotidiennement. Si vous ne pouvez pas, il convient de séparer les apports en au moins trois fois.
Sans spécification particulière, cela signifie que je parle de dose hebdomadaire.
Utilisez le calculateur pour les ajouts de fer et de PO4 ! Ne faites pas attention à la dose proposée par le fabricant.
Si vous avez un éclairage HQI, l'absorption hebdomadaire de KNO3 est 4 fois plus élevée. La dose de départ devrait être de 4 grammes tous les 50 gallons si vous avez assez de plantes.
2. Fertilisation avancée
a) KNO3 et PO4
Le protocole générique KNO3 sera l'outil principal pour le contrôle des algues. Nous allons l'utiliser pour découvrir l'absorption réelle de notre aquarium en NO3.
Protocole générique KNO3:
1. J1 : changer 50 % de l'eau du bac.
2. Arrêt de toute autre fertilisation en cours.
3. Ajouter quotidiennement 1 gramme de KNO3 pour 50 gallons (190 L) jusqu'à l'apparition de GSA.
4. Dès leur apparition ou le septième jour, changer 50 % de l'eau du bac.
5. Si la GSA n'a pas proliférée la première semaine, après le changement d'eau, doubler la quantité de KNO3 durant la semaine suivante.
Dans la MCI, le protocole fonctionne de la manière suivante :
Ajoutez du KNO3 tous les jours, supposons que les GSA apparaissent le jour 3 dans un bac de 50 gallons (190 litres). La dose hebdomadaire de KNO3 sera de 3 grammes divisés en sept jours.
Si votre aquarium est vraiment bien équilibré, la quantité de Kno3 restante dans l'eau devrait être basse. Si les NO3 augmentent, cela signifie que vous avez des problèmes liés au CO2, au KH, un manque de lumière, une surpopulation, une mauvaise qualité de l'eau du robinet, etc. Dans ce cas, vous devriez vérifier les conditions préalables.
Au sujet des PO4, vous vous demandez pourquoi je les "limite" . Un aquarium équilibré a tendance à manquer "naturellement" de NO3 alors que les PO4 sont en excès. Pour cette raison, je suggère d'observer votre bac et d'ajouter des PO4 seulement si vous en avez besoin. Les GSA et une taille anormalement petite des feuilles sont les symptômes d'une réelle carence en PO4. D'autre part, nous savons que les microsorums, anubias et marsilea crenata consomment beaucoup de PO4, dans ce cas il pourra être nécessaire d'ajouter des PO4.
Je voudrais apporter une clarification. Si nous augmentons les apports, cela ne signifie pas que les plantes absorberont de plus grandes quantités. Si nos apports sont excessifs, cela montre que nous n'avons aucune idée de la quantité réellement nécessaire. Il faut rechercher l'équilibre.
Je sais que je limite probablement les nutriments disponibles mais je crois que ce concept, provenant de la culture hydroponique, ne peut pas être utilisé sans un ajustement préalable pour la cultures immergée. La raison est simple, en plus de la croissance des plantes, nous devons également surveiller le développement des algues. Donc, l'idée derrière la MCI n'est pas de limiter quoi que ce soit, je cherche plutôt le bon fonctionnement. Je gagnais ma vie en cultivant des plantes d'aquarium immergées et j'avais un taux de croissance important, sans algue. Le développement d'algues n'était tout simplement pas envisageable pour moi dans ce cas.
En fait, je limite les ressources mais pas PO4, je limite le K. Je ne veux pas que ma concentration en NO3 devienne nulle, ce qui peut se produire si on ajoute trop de K.
Il faut bien avoir en tête que certaines plantes peuvent consommer prioritairement certains nutriments par rapport à d'autres. Cela signifie que les plantes consommant spécifiquement un macro-nutriment en priorité vont définir la fertilisation.
Si nous devons ajouter des PO4 parce que nous avons des plantes qui l'exigent, nous avons deux choix:
1. Il peut ne pas y avoir de preuve du manque de PO4 (pas d'apparition de GSA par exemple). Cela se produit lorsque nous avons des plantes avec une consommation prioritaire en PO4 mais qui n'est pas suffisante pour modifier significativement la chimie de l'eau. Dans ce cas, nous pouvons ajouter un peu de PO4 sur les feuilles avec une seringue sans aiguille. Le quantité ainsi ajoutée peut être insignifiante par rapport à la concentration du nutriment dans l'eau mais en terme de consommation, cela peut être plus que suffisant.
2. Dans le second scénario, les GSA apparaissent après arrêt d'ajout de PO4. Dans ce cas, il conviendra d'utiliser le protocole PO4 pour déterminer la consommation réelle de ce macro-nutriment. Le protocole PO4 (en terme de contrôle des algues : il permet de lutter contre les GSA ; en ce qui concerne la fertilisation, il est utile pour déterminer la consommation de PO4) est le suivant:
1. J1 : changer 50 % de l'eau du bac.
2. Continuez à ajouter du KNO3.
3. Nettoyez les vitres des GSA quotidiennement.
4. Ajouter quotidiennement 1 gramme de PO4 pour 500 gallons (1900 litres) jusqu'à ce que les GSA n'apparaissent plus.
5. Dès que vous atteignez ce point ou au septième jour, changer 50 % de l'eau du bac.
6. Si le développement des GSA ne s'arrête pas à la fin de la première semaine, après le changement d'eau, doubler la quantité de PO4 pendant la deuxième semaine et ainsi de suite.
Une fois que la GSA arrête de proliférer, nous utilisons la dose totale de PO4 apportée comme apport hebdomadaire de PO4. S'il a fallu trois semaines pour stopper la prolifération, vous n'utilisez que le quantité apportée lors de la dernière semaine pour calculer vos apports.
b) Ca et Mg
Le ratio 4: 1 Ca: Mg n'est pas adapté à la culture immergée. Quand il y a trop de PO4 dans l'eau et que vous avez un déséquilibre dans au niveau du rapport Ca:Mg, vous aurez des GDA. Si vous ajoutez ces macros, le ratio devrait être l'inverse : 1:4 de Ca:Mg. Vous ne pouvez donc pas ajouter trop de Ca car le Mg ne peut pas être ajouté en grande quantité.
Il est possible d'estimer le ratio Ca:Mg dont nous avons besoin de la même manière qu'avec les NO3 et PO4. Cependant, si vous débutez, je vous suggère d'attendre un peu avant de réaliser cette estimation.
Le protocole pour le Mg est:
1. J1 : changer 50 % de l'eau du bac.
2. Arrêt de toute autre fertilisation en cours.
3. Ajouter 0,3 ppm de Mg par jour jusqu'à ce que les algues "RODOPHYTAS SP. 3" (voir le chapitre dédié, point 3) prolifèrent.
4. Ensuite, utilisez le protocole spécifique contre cette algue que vous trouverez dans le chapitre sur le contrôle des algues.
Avec ce protocole, vus estimerez les apports nécessaires en Mg. Pour le Ca, il suffit d'ajouter 25% de la quantité ajoutée pour le Mg.
Il n'est pas forcément nécessaire d'aller jusqu'au développement de cette algue, la Rotala wallichi peut aussi être utilisée comme bio-indicateur car elle fond quand il y a trop de Mg.
La Rotala Macranta est une plante consommant prioritairement du Ca, elle va donc modifier la consommation de cet élément. Il en va de même pour l'Ammania gracilis, qui devient noire en cas de carence en Ca.
Le rapport Ca:Mg que je suggère est une généralité. Les plantes avec des besoins prioritaires modifient toujours ce genre de règle, mais en utilisant les étapes que je mentionne et les algues comme bio-indicateurs, comme l'homme aveugle avec sa canne, vous trouverez l'équilibre de votre aquarium.
Je n'aime pas utiliser le chlorure de calcium car il peut brûler les feuilles des microsorums. Habituellement, avec les changements d'eau, vous ajoutez suffisamment de Ca. Une autre option si votre eau a un faible KH est d'utiliser de l'aragonite dans votre filtre. Cela devrait être suffisant pour les plantes standards.
En cas de déséquilibre lié au Ca, vous aurez des algues "RODOPHYTAS SP. 2" (voir le chapitre dédié) ou, si vous avez en même temps un déséquilibre lié au PO4, alors vous aurez une prolifération de GDA.
c) Le potassium
L'une des particularités du MCI est que je ne recommande pas l'utilisation du sulfate de potassium. Les raisons sont les suivantes :
La première est que si vous ajoutez ce macro-nutriment, le NO3 sera consommé et dès que sa concentration sera nulle, vous aurez des problèmes d'algues. L'objectif principal, je pense, est d'éviter cette situation. Le but de la MCI est d'avoir une chimie de l'eau stable, toujours proches de l'apparition de GSA. Si nous ajoutons K, cette stabilité disparaît.
D'un autre côté, il vaut mieux si possible ne pas ajouter de soufre. Son oxydation par les bactéries peut produire de l'acide sulfurique. Si vous ajoutez beaucoup de Fe, vous modifiez le rapport redox, évitant cette réaction mais il est plus simple de limiter l'apport de soufre.
Si vous avez une eau dure, vous avez probablement assez de soufre et en en ajoutant plus, des GLHA (algues grises à poils longs, voir le chapitre sur le contrôle des algues) apparaitront.
Le K est nécessaire, sans aucun doute. Mais la faible ajoutée avec le KNO3 est plus que suffisante. Si mon hypothèse est fausse, alors les microsorums pteropus deviendront noirs.
L'Hygrophila polisperma est une plante qui consomme du K en priorité. J'ai lu qu'il est proposé d'utiliser cette plante comme un bio-indicateur de l'absence de K. C'est une erreur, l'absorption de K avec cette plante dans votre aquarium deviendra importante.
Cette plante a la capacité de se développer uniquement avec de l'eau et du sulfate de potassium.
d) Carbonate de sodium, de calcium et de potassium
L'ajout le carbonate dans l'eau d'un aquarium planté est complexe. Ajouter du carbonate/bicarbonate de potassium ou de calcium est presque une évidence
Cependant, nous ne tenons alors pas compte de la quantité totale de K que nous ajoutons dans l'eau. Si l'on ajoute du phosphate de potassium, du nitrate de potassium et du carbonate ou du bicarbonate de potassium, nous pouvons facilement atteindre les 50 ppm de K. Si on ajoute aussi du sulfate de potassium, la quantité de K sera trop élevée. Le K par lui-même n'est pas un problème comme le fer qui peut devenir un poison à forte concentration mais il pourra engendrer la consommation de l'ensemble des NO3, ce qui posera problème.
Si nous ne voulons pas ajouter autant de K, alors la solution est de combiner les carbonates/bicarbonates de calcium, sodium et potassium afin de les garder à des concentrations acceptables.
Comme je l'ai déjà expliqué dans le chapitre Ca/Mg, il convient de rester prudent vis-à-vis de la quantité de Ca que nous ajoutons si nous ne voulons pas avoir de problèmes d'algues rouges ou de GDA.
D'un autre côté, les discus et les apistos sont sensibles au Ca.
La raison de l'ajout de carbonates dans l'eau est de conserver un pouvoir tampon, afin d'éviter une forte baisse de pH.
Je suis née à Buenos Aires, en Argentine. Nous vivons juste à côté de la rivière De La Plata qui naît dans les marais du Mato Groso au Brésil. L'eau du robinet a un KH de 1,5 et contient très peu de Ca. Je n'ai jamais eu de problèmes lié au faible pouvoir tampon. Même si le pH baisse, ce n'est pas une chute sans fin. Seuls les poissons d'eau dure et vivants à pH élevé ont de sérieux problèmes. Le Botia macracanta en fait partie.
Je ne conseille pas d'avoir un pH de 5,5, j'explique juste que ce n'est pas un gros problème pour les poissons.
Nous avons cette eau très douce et les aquariophiles ont utilisé avec succès l'aragonite pendant des décennies pour éviter d'avoir un pouvoir tampon trop faible. L'aragonite, sable de corail, est plus dense que le carbonate de calcium standard que nous pouvons acheter. L'avantage est que l'eau ne deviendra pas blanche et de part sa composition, elle sera dissoute lentement par le CO2.
Nous avons seulement besoin d'une petite quantité d'aragonite dans notre filtre.
e) Fe
La MCI fonctionne avec un apport de seulement 0,1 ppm de Fe par semaine.
Les méhodes PPS et EI utilisent des niveaux plus élevés de Fe. Le Fe réduit le potentiel redox, ce qui pourrait être utile si vous avez trop de soufre dans votre eau ou si elle est polluée. D'un autre côté, en présence de PO4 et de Fe, cela formera du phosphate de fer.
Il y a beaucoup de débats pour savoir si les plantes peuvent l'absorber ou non. C'est peu important pour nous. Vous pouvez savoir combien de Fe vos plantes absorbent en en ajoutant 0,025 ppm par jour jusqu'à ce que vous obteniez des algues. Je crois que ce n'est pas nécessaire, mais vous pouvez le faire si vous en avez envie. Les algues qui proliféreront à cause de l'excès de fer peuvent être stoppées avec le protocole générique KNO3 mais vous aurez besoin de glutaraldéhyde (Flourish excel, Easy Carbo) pour les éliminer.
Cependant, je crois que la meilleure solution est d'ajouter du PO4 et du Fe en alternance. De mon point de vue, 0,1 ppm de Fe est suffisant. Quoi qu'il en soit, vos plantes vous diront si vous avez vraiment besoin de plus.
Vous pouvez avoir des concentrations en Fe plus élevés dans vos bacs sans avoir de prolifération d'algue, mais le bac sera moins stable et que cela n'est pas nécessaire. Les plantes ne mourront pas de faim si vous ajoutez du Fe de manière plus efficace.
Mais tout se joue sur l'observation, il ne faut pas mélanger les méthodes. Vous pouvez ajouter moins de Fe si vous ajoutez moins de PO4. Comme je l'ai déjà expliqué, il s'agit de déséquilibres plutôt que de manque ou d'excès.
La MCI est une méthode de fertilisation et de contrôle des algues. Même s'il s'agit avant tout d'une méthode de contrôle des algues, son potentiel de fertilisation est aussi évident. D'autres méthodes de fertilisation prétendent simplement que les algues n'existent pas et n'assument aucune responsabilité à leur égard. Je crois que les algues et la fertilisation sont deux faces de la même pièce. Les algues nous donnent des informations sur la façon d'opérer. Si quelque chose ne va pas, elles prolifèrent. Peu importe la méthode de fertilisation que vous pensez utiliser, dès que vous avez de l'expérience, vous développez votre propre méthode, même si vous ne vous en rendez pas compte. Mais parfois il y a des problèmes récurrents que vous ne pouvez pas résoudre, c'est un élément que vous devriez prendre en compte. Parfois, le problème vient de vous, parfois le problème est que vous utilisez une mauvaise théorie. J'entends par mauvaise théorie, une idée qui ne fonctionne pas et qui de ce fait devrait être abandonnée au lieu d'inventer une pseudo explication scientifique quand cela ne fonctionne toujours pas. Les GDA sont le meilleur exemple. Même s'il y a une très belle explication sur le cycle de vie de cette algue, la solution proposée (attendre) est... comment dire ?... la preuve que l'auteur n'a aucune idée sur la façon d'y faire face. Mais ce n'est pas le bon chapitre pour expliquer cela, traitons de la fertilisation.
1. Généralités
A. A propos des micros et du Fe, si vous en ajoutez 3 fois plus que ce que vos plantes consomment, vous aurez des problèmes d'algues rouges, en supposant que votre bac remplit les conditions préalablement décrites.
A propos du chlorure de calcium, même une faible quantité peut brûler les feuilles des microsorum. Pour cette raison, je ne recommande pas de l'utiliser.
La base de la MCI est la fertilisation avec KNO3, mais pas uniquement, c'est juste un point de départ. La dose que je recommande comme point de départ pour les débutants est de 1 gramme pour 50 gallons (190 litres) par semaine. L'idée est de chercher l'absorption réelle de votre bac, nous allons utiliser le protocole générique KNO3 pour cela. Il consiste à ajouter cette dose tous les jours jusqu'à ce que les GSA apparaissent. Ensuite, la quantité de KNO3 que vous avez ajoutée est la quantité hebdomadaire de KNO3 que vous allez utiliser à l'avenir afin d'avoir une chimie de l'eau proche de l'apparition des GSA.
A propos des phosphates, pour démarrer, je recommande de ne pas en apporter pour le moment. Cependant, la dose que je vais utiliser pour le protocole PO4 est de 1 gramme tous les 500 gallons (1900 litres).
A propos du dosage, les balances électroniques sont si peu coûteuses qu'il n'y a aucune excuse pour ne pas en acheter une.
b. Clarification préliminaire
Lorsque nous parlons de dose hebdomadaire, les apports devraient être faits quotidiennement. Si vous ne pouvez pas, il convient de séparer les apports en au moins trois fois.
Sans spécification particulière, cela signifie que je parle de dose hebdomadaire.
Utilisez le calculateur pour les ajouts de fer et de PO4 ! Ne faites pas attention à la dose proposée par le fabricant.
Si vous avez un éclairage HQI, l'absorption hebdomadaire de KNO3 est 4 fois plus élevée. La dose de départ devrait être de 4 grammes tous les 50 gallons si vous avez assez de plantes.
2. Fertilisation avancée
a) KNO3 et PO4
Le protocole générique KNO3 sera l'outil principal pour le contrôle des algues. Nous allons l'utiliser pour découvrir l'absorption réelle de notre aquarium en NO3.
Protocole générique KNO3:
1. J1 : changer 50 % de l'eau du bac.
2. Arrêt de toute autre fertilisation en cours.
3. Ajouter quotidiennement 1 gramme de KNO3 pour 50 gallons (190 L) jusqu'à l'apparition de GSA.
4. Dès leur apparition ou le septième jour, changer 50 % de l'eau du bac.
5. Si la GSA n'a pas proliférée la première semaine, après le changement d'eau, doubler la quantité de KNO3 durant la semaine suivante.
Dans la MCI, le protocole fonctionne de la manière suivante :
Ajoutez du KNO3 tous les jours, supposons que les GSA apparaissent le jour 3 dans un bac de 50 gallons (190 litres). La dose hebdomadaire de KNO3 sera de 3 grammes divisés en sept jours.
Si votre aquarium est vraiment bien équilibré, la quantité de Kno3 restante dans l'eau devrait être basse. Si les NO3 augmentent, cela signifie que vous avez des problèmes liés au CO2, au KH, un manque de lumière, une surpopulation, une mauvaise qualité de l'eau du robinet, etc. Dans ce cas, vous devriez vérifier les conditions préalables.
Au sujet des PO4, vous vous demandez pourquoi je les "limite" . Un aquarium équilibré a tendance à manquer "naturellement" de NO3 alors que les PO4 sont en excès. Pour cette raison, je suggère d'observer votre bac et d'ajouter des PO4 seulement si vous en avez besoin. Les GSA et une taille anormalement petite des feuilles sont les symptômes d'une réelle carence en PO4. D'autre part, nous savons que les microsorums, anubias et marsilea crenata consomment beaucoup de PO4, dans ce cas il pourra être nécessaire d'ajouter des PO4.
Je voudrais apporter une clarification. Si nous augmentons les apports, cela ne signifie pas que les plantes absorberont de plus grandes quantités. Si nos apports sont excessifs, cela montre que nous n'avons aucune idée de la quantité réellement nécessaire. Il faut rechercher l'équilibre.
Je sais que je limite probablement les nutriments disponibles mais je crois que ce concept, provenant de la culture hydroponique, ne peut pas être utilisé sans un ajustement préalable pour la cultures immergée. La raison est simple, en plus de la croissance des plantes, nous devons également surveiller le développement des algues. Donc, l'idée derrière la MCI n'est pas de limiter quoi que ce soit, je cherche plutôt le bon fonctionnement. Je gagnais ma vie en cultivant des plantes d'aquarium immergées et j'avais un taux de croissance important, sans algue. Le développement d'algues n'était tout simplement pas envisageable pour moi dans ce cas.
En fait, je limite les ressources mais pas PO4, je limite le K. Je ne veux pas que ma concentration en NO3 devienne nulle, ce qui peut se produire si on ajoute trop de K.
Il faut bien avoir en tête que certaines plantes peuvent consommer prioritairement certains nutriments par rapport à d'autres. Cela signifie que les plantes consommant spécifiquement un macro-nutriment en priorité vont définir la fertilisation.
Si nous devons ajouter des PO4 parce que nous avons des plantes qui l'exigent, nous avons deux choix:
1. Il peut ne pas y avoir de preuve du manque de PO4 (pas d'apparition de GSA par exemple). Cela se produit lorsque nous avons des plantes avec une consommation prioritaire en PO4 mais qui n'est pas suffisante pour modifier significativement la chimie de l'eau. Dans ce cas, nous pouvons ajouter un peu de PO4 sur les feuilles avec une seringue sans aiguille. Le quantité ainsi ajoutée peut être insignifiante par rapport à la concentration du nutriment dans l'eau mais en terme de consommation, cela peut être plus que suffisant.
2. Dans le second scénario, les GSA apparaissent après arrêt d'ajout de PO4. Dans ce cas, il conviendra d'utiliser le protocole PO4 pour déterminer la consommation réelle de ce macro-nutriment. Le protocole PO4 (en terme de contrôle des algues : il permet de lutter contre les GSA ; en ce qui concerne la fertilisation, il est utile pour déterminer la consommation de PO4) est le suivant:
1. J1 : changer 50 % de l'eau du bac.
2. Continuez à ajouter du KNO3.
3. Nettoyez les vitres des GSA quotidiennement.
4. Ajouter quotidiennement 1 gramme de PO4 pour 500 gallons (1900 litres) jusqu'à ce que les GSA n'apparaissent plus.
5. Dès que vous atteignez ce point ou au septième jour, changer 50 % de l'eau du bac.
6. Si le développement des GSA ne s'arrête pas à la fin de la première semaine, après le changement d'eau, doubler la quantité de PO4 pendant la deuxième semaine et ainsi de suite.
Une fois que la GSA arrête de proliférer, nous utilisons la dose totale de PO4 apportée comme apport hebdomadaire de PO4. S'il a fallu trois semaines pour stopper la prolifération, vous n'utilisez que le quantité apportée lors de la dernière semaine pour calculer vos apports.
b) Ca et Mg
Le ratio 4: 1 Ca: Mg n'est pas adapté à la culture immergée. Quand il y a trop de PO4 dans l'eau et que vous avez un déséquilibre dans au niveau du rapport Ca:Mg, vous aurez des GDA. Si vous ajoutez ces macros, le ratio devrait être l'inverse : 1:4 de Ca:Mg. Vous ne pouvez donc pas ajouter trop de Ca car le Mg ne peut pas être ajouté en grande quantité.
Il est possible d'estimer le ratio Ca:Mg dont nous avons besoin de la même manière qu'avec les NO3 et PO4. Cependant, si vous débutez, je vous suggère d'attendre un peu avant de réaliser cette estimation.
Le protocole pour le Mg est:
1. J1 : changer 50 % de l'eau du bac.
2. Arrêt de toute autre fertilisation en cours.
3. Ajouter 0,3 ppm de Mg par jour jusqu'à ce que les algues "RODOPHYTAS SP. 3" (voir le chapitre dédié, point 3) prolifèrent.
4. Ensuite, utilisez le protocole spécifique contre cette algue que vous trouverez dans le chapitre sur le contrôle des algues.
Avec ce protocole, vus estimerez les apports nécessaires en Mg. Pour le Ca, il suffit d'ajouter 25% de la quantité ajoutée pour le Mg.
Il n'est pas forcément nécessaire d'aller jusqu'au développement de cette algue, la Rotala wallichi peut aussi être utilisée comme bio-indicateur car elle fond quand il y a trop de Mg.
La Rotala Macranta est une plante consommant prioritairement du Ca, elle va donc modifier la consommation de cet élément. Il en va de même pour l'Ammania gracilis, qui devient noire en cas de carence en Ca.
Le rapport Ca:Mg que je suggère est une généralité. Les plantes avec des besoins prioritaires modifient toujours ce genre de règle, mais en utilisant les étapes que je mentionne et les algues comme bio-indicateurs, comme l'homme aveugle avec sa canne, vous trouverez l'équilibre de votre aquarium.
Je n'aime pas utiliser le chlorure de calcium car il peut brûler les feuilles des microsorums. Habituellement, avec les changements d'eau, vous ajoutez suffisamment de Ca. Une autre option si votre eau a un faible KH est d'utiliser de l'aragonite dans votre filtre. Cela devrait être suffisant pour les plantes standards.
En cas de déséquilibre lié au Ca, vous aurez des algues "RODOPHYTAS SP. 2" (voir le chapitre dédié) ou, si vous avez en même temps un déséquilibre lié au PO4, alors vous aurez une prolifération de GDA.
c) Le potassium
L'une des particularités du MCI est que je ne recommande pas l'utilisation du sulfate de potassium. Les raisons sont les suivantes :
La première est que si vous ajoutez ce macro-nutriment, le NO3 sera consommé et dès que sa concentration sera nulle, vous aurez des problèmes d'algues. L'objectif principal, je pense, est d'éviter cette situation. Le but de la MCI est d'avoir une chimie de l'eau stable, toujours proches de l'apparition de GSA. Si nous ajoutons K, cette stabilité disparaît.
D'un autre côté, il vaut mieux si possible ne pas ajouter de soufre. Son oxydation par les bactéries peut produire de l'acide sulfurique. Si vous ajoutez beaucoup de Fe, vous modifiez le rapport redox, évitant cette réaction mais il est plus simple de limiter l'apport de soufre.
Si vous avez une eau dure, vous avez probablement assez de soufre et en en ajoutant plus, des GLHA (algues grises à poils longs, voir le chapitre sur le contrôle des algues) apparaitront.
Le K est nécessaire, sans aucun doute. Mais la faible ajoutée avec le KNO3 est plus que suffisante. Si mon hypothèse est fausse, alors les microsorums pteropus deviendront noirs.
L'Hygrophila polisperma est une plante qui consomme du K en priorité. J'ai lu qu'il est proposé d'utiliser cette plante comme un bio-indicateur de l'absence de K. C'est une erreur, l'absorption de K avec cette plante dans votre aquarium deviendra importante.
Cette plante a la capacité de se développer uniquement avec de l'eau et du sulfate de potassium.
d) Carbonate de sodium, de calcium et de potassium
L'ajout le carbonate dans l'eau d'un aquarium planté est complexe. Ajouter du carbonate/bicarbonate de potassium ou de calcium est presque une évidence
Cependant, nous ne tenons alors pas compte de la quantité totale de K que nous ajoutons dans l'eau. Si l'on ajoute du phosphate de potassium, du nitrate de potassium et du carbonate ou du bicarbonate de potassium, nous pouvons facilement atteindre les 50 ppm de K. Si on ajoute aussi du sulfate de potassium, la quantité de K sera trop élevée. Le K par lui-même n'est pas un problème comme le fer qui peut devenir un poison à forte concentration mais il pourra engendrer la consommation de l'ensemble des NO3, ce qui posera problème.
Si nous ne voulons pas ajouter autant de K, alors la solution est de combiner les carbonates/bicarbonates de calcium, sodium et potassium afin de les garder à des concentrations acceptables.
Comme je l'ai déjà expliqué dans le chapitre Ca/Mg, il convient de rester prudent vis-à-vis de la quantité de Ca que nous ajoutons si nous ne voulons pas avoir de problèmes d'algues rouges ou de GDA.
D'un autre côté, les discus et les apistos sont sensibles au Ca.
La raison de l'ajout de carbonates dans l'eau est de conserver un pouvoir tampon, afin d'éviter une forte baisse de pH.
Je suis née à Buenos Aires, en Argentine. Nous vivons juste à côté de la rivière De La Plata qui naît dans les marais du Mato Groso au Brésil. L'eau du robinet a un KH de 1,5 et contient très peu de Ca. Je n'ai jamais eu de problèmes lié au faible pouvoir tampon. Même si le pH baisse, ce n'est pas une chute sans fin. Seuls les poissons d'eau dure et vivants à pH élevé ont de sérieux problèmes. Le Botia macracanta en fait partie.
Je ne conseille pas d'avoir un pH de 5,5, j'explique juste que ce n'est pas un gros problème pour les poissons.
Nous avons cette eau très douce et les aquariophiles ont utilisé avec succès l'aragonite pendant des décennies pour éviter d'avoir un pouvoir tampon trop faible. L'aragonite, sable de corail, est plus dense que le carbonate de calcium standard que nous pouvons acheter. L'avantage est que l'eau ne deviendra pas blanche et de part sa composition, elle sera dissoute lentement par le CO2.
Nous avons seulement besoin d'une petite quantité d'aragonite dans notre filtre.
e) Fe
La MCI fonctionne avec un apport de seulement 0,1 ppm de Fe par semaine.
Les méhodes PPS et EI utilisent des niveaux plus élevés de Fe. Le Fe réduit le potentiel redox, ce qui pourrait être utile si vous avez trop de soufre dans votre eau ou si elle est polluée. D'un autre côté, en présence de PO4 et de Fe, cela formera du phosphate de fer.
Il y a beaucoup de débats pour savoir si les plantes peuvent l'absorber ou non. C'est peu important pour nous. Vous pouvez savoir combien de Fe vos plantes absorbent en en ajoutant 0,025 ppm par jour jusqu'à ce que vous obteniez des algues. Je crois que ce n'est pas nécessaire, mais vous pouvez le faire si vous en avez envie. Les algues qui proliféreront à cause de l'excès de fer peuvent être stoppées avec le protocole générique KNO3 mais vous aurez besoin de glutaraldéhyde (Flourish excel, Easy Carbo) pour les éliminer.
Cependant, je crois que la meilleure solution est d'ajouter du PO4 et du Fe en alternance. De mon point de vue, 0,1 ppm de Fe est suffisant. Quoi qu'il en soit, vos plantes vous diront si vous avez vraiment besoin de plus.
Vous pouvez avoir des concentrations en Fe plus élevés dans vos bacs sans avoir de prolifération d'algue, mais le bac sera moins stable et que cela n'est pas nécessaire. Les plantes ne mourront pas de faim si vous ajoutez du Fe de manière plus efficace.
Mais tout se joue sur l'observation, il ne faut pas mélanger les méthodes. Vous pouvez ajouter moins de Fe si vous ajoutez moins de PO4. Comme je l'ai déjà expliqué, il s'agit de déséquilibres plutôt que de manque ou d'excès.
 alexv95Spécialiste plantes
alexv95Spécialiste plantes
 Nombre de messages : 3171
Nombre de messages : 3171
Localisation : Val d'Oise
Emploi : Jardinier aquatique
Date d'inscription : 10/11/2012
 Re: La méthode des déséquilibres controlés
Re: La méthode des déséquilibres controlés
Sam 23 Déc 2017 - 11:23
VI. APPROCHE DE CONTRÔLE DES ALGUES
LES DÉSÉQUILIBRES CONTRÔLÉS
Dans ce chapitre, je vais décrire le protocole (par étapes) que j'ai utilisé avec succès pour dans un premier temps modifier l'équilibre de l'aquarium pour faire apparaitre les GSA, et dans un second temps pour trouver un équilibre durable sans aucune algue.
A. LES ALGUES VERTES
A.1. L'EAU VERTE

Les causes du développement de cette algue ne sont pas clairement identifiées. Dans ce que j'ai pu observer, elle se développe toujours lorsque les niveaux de NO3 et de PO4 sont élevés simultanément. Cependant, il semble que ce ne soit pas la seule situation dans laquelle elle se développe. L'eau verte est fréquente peu après la mise en route d'un bac, nous pouvons émettre l'hypothèse que les nitrites peuvent également être consommés par cette algue.
Les changements d'eau n'y changeront rien, généralement c'est même pire après.
Pour éviter l'eau verte, le mieux est de mettre en place dans le nouvel aquarium de nombreuses plantes à croissance rapide, même s'il ne s'agit pas des espèces que vous garderez ensuite dans le bac.
Elle peut être stoppée en utilisant pour du Tetra Bactozym (il s'agit de gélules accélérant la colonisation des filtres par les bactéries "utiles").
Un filtre UV est la meilleure solution. Faire un changement d'eau de 50% à la mise en route du tube UV et renouveler ce changement à J7. Arrêtez de fertiliser durant le traitement.
A.2. GREEN STRING ALGAE (GSA)
Cette algue est liée à la présence d'ammoniaque. Il convient de vous référer à la section sur la qualité de l'eau afin d'identifier l'origine de cette substance dans votre bac.
PROTOCOLE
1. J1, changer 50 % de l'eau de votre bac. Vérifiez que l'eau que vous ajoutez est exempte d'ammoniaque.
2. Ne pas diminuez la puissance de votre éclairage.
3. Vérifiez la concentration en CO2.
4. Ajouter directement au niveau des algues avec une seringue sans aiguille 10 ml / 25 gallons (95 litres) de peroxyde d'hydrogène, le glutaraldéhyde (Flourish Excel) peut également être utilisé. Cependant, ces produits tuent les algues mais ne traite pas la cause .
5. Arrêtez la fertilisation en cours.
6. Ajouter 1 gramme de KNO3 pour 50 gallons (190 litres) par jour.
7. J7, changer 50 % de l'eau de votre bac.
Si vous avez suffisamment de crevettes, ces dernières peuvent facilement manger cette algue, mais cela ne résoudra pas le déséquilibre qui a causé sa prolifération. 1 crevette par litre peuvent nettoyer un bac en deux jours. C'est une solution facile si vous en avez déjà ou si elles sont bon marché. Là où je vis un sac de 200 crevettes coûte environ 2 dollars (c'est injuste ), elles sont utilisées comme nourriture vivante.
), elles sont utilisées comme nourriture vivante.
A.3. Sp. SHORT GREEN ALGAE

J'ai été affecté par cette algue entre le moment où j'ai vendu mon ancien filtre et celui où j'ai reçu le nouveau. Mon aquarium a beaucoup d'échinodorus et quelques plantes à croissance rapide. Une semaine après l'installation du nouveau filtre et après ajout de plantes supplémentaires, cette algue a disparu.
A.4. GREEN SPOT ALGAE (GSA)

La GSA est liée à un déséquilibre entre les PO4 et les NO3. Globalement, il n'y a pas de PO4.
PROTOCOLE:
1. J1, changer 50 % de l'eau de votre bac.
2. Continuez à ajouter du KNO3.
3. Nettoyez les GSA sur les vitres quotidiennement.
4. Ajouter quotidiennement 1 gramme de PO4 tous les 500 gallons (1900 litres) jusqu'à ce que les GSA n'apparaissent plus.
5. Dès que vous atteignez ce point ou à J7, changer 50 % de l'eau.
6. Si la GSA n'a pas arrêté de proliférer la première semaine, après le changement d'eau, doubler la quantité de KNO3 pendant la deuxième semaine et ainsi de suite.
A.5. CLADOPHORA

Cette algue est liée à un déséquilibre entre l'éclairage et le CO2.
Vérifiez votre concentration en CO2. Lisez le chapitre sur le CO2 pour en savoir plus sur la quantité qui peut être difusée sans risquer votre faune. S'il n'y a aucun moyen d'ajouter plus de CO2, vous devriez diminuer l'éclairage. Cela pourrait se produire lorsque le bac est exposé à la lumière naturelle en été.
Vous pouvez utiliser du Flourish Excel pour tuer cette algue, en ajoutant 4 fois la dose recommandée.
Si vous avez des crevettes dans votre bac et que vous ne voulez prendre le risque d'ajouter plus de CO2, vous pouvez compenser en utilisant du Flourish Excel et du CO2.
Les Riccia, Egeria densa et hemianthus micrantemoides souffrent beaucoup des surdosages en Flourish Excel.
PROTOCOLE
1. Vérifiez le niveau de CO2.
2. Utilisez le protocole générique KNO3
3. Ajoutez 4 fois la dose recommandée en Flourish Excel
B. BGA: CYANOBACTÉRIE (OSCILLIOTA SPLENDENS)

Les cyanobactéries sont liées à un déséquilibre entre le NO3 et le PO4. Cela signifie qu'il y a trop de PO4, ou peut survenir lorsqu'il n'y a plus de NO3.
Si vous avez des discus, le problème est probablement lié à un excès de PO4.
Si vous avez un tapis de glossostigma elatinoides alors le problème vient probablement de l'absence de NO3.
Les cyanobactéries peuvent être éliminées de la même manière que les bactéries. Vous pouvez ajouter directement au niveau des algues avec une seringue sans aiguille 10 ml / 25 gallons (95 litres) de peroxyde d'hydrogène une fois par jour. L'érythromycine peut être utilisée seulement quand vous avez trop de cyano.
PROTOCOLE 1
Si la cyano est en faible quantité, sa prolifération est probablement causée par l'absence de NO3. Cela arrive généralement lorsque vous avez des glossostigma elatinoides ou beaucoup de plantes à croissance rapide.
1. Utilisez le protocole générique KNO3.
2. Siphonnez les cyanobactéries ou utilisez du peroxyde d'hydrogène.
PROTOCOLE 2
1. Utilisez le protocole générique KNO3 mais doublez la quantité de KNO3.
2. Plonger l'aquarium complétement dans le noir (black-out) pendant 3 jours.
3. Après les 3 jours, redémarrez le protocole générique KNO3 avec la quantité standard de KNO3 jusqu'à l'apparition de GSA.
PROTOCOLE 3
1. Utilisez le protocole générique KNO3 mais doublez la quantité de KNO3.
2. Plonger l'aquarium complétement dans le noir (black-out) pendant 3 jours.
3. Ajoutez 500 mg d'érythromycine pour 25 gallons (95 litres) une fois par jour.
4. Après 3 jours, redémarrez le protocole générique KNO3 avec la quantité standard de KNO3 jusqu'à l'apparition de GSA.
C. GREEN DUST ALGAE (GDA)

Il y a beaucoup de confusions à propos de cette algue. La méthode EI suggère d'attendre la fin du cycle de vie de cette algue (3 semaines).
Cependant, un de mes amis a attendu 6 mois, la photo provient de son bac.
J'ai testé l'eau et j'ai découvert un déséquilibre complexe lié à 1) au ratio Ca:Mg, le Ca étant en excès et 2) NO3:PO4, les PO4 étant en excès également.
Trois jours plus tard, après avoir travaillé sur ces déséquilibres, le problème a été résolu.
PROTOCOLE:
1. Utilisez le protocole générique KNO3
2. Nettoyez les vitres tous les jours jusqu'à ce que les GDA n'apparaissent plus.
3. À l'avenir, vous devriez viser un ratio Ca:Mg de 1:4.
4. Si vous ajoutez PO4, lisez le chapitre dédié sur les PO4.
5. Lisez également le chapitre sur la qualité de l'eau à propos des excès de PO4 et de Ca dans l'eau du robinet.
D.1. RHODOPHYTA SP.1
Cette algue est liée à un excès de Fe.

1. Utilisez le protocole générique KNO3
2. Ajoutez directement sur les algues avec une seringue sans aiguille 10 ml / 25 gallons (95 litres) de peroxyde d'hydrogène une fois par jour. Le Flourish Excel peut également être utilisé, à 4 fois la dose recommandée.
3. À l'avenir, vous devrez baisser vos apports de Fer en apportant 1/3 de la dose initiale.
D.2. RHODOPHYTA SP. 2

Cette algue est liée à un déséquilibre complexe avec un excès de Ca par rapport au Mg, avec également un excès de Fe.
1. Utilisez le protocole générique KNO3
2. Ajoutez directement sur les algues avec une seringue sans aiguille 10 ml / 25 gallons (95 litres) de peroxyde d'hydrogène une fois par jour. Le Flourish Excel peut également être utilisé, à 4 fois la dose recommandée.
3. À l'avenir, vous devrez baisser vos apports de Fer en apportant 1/3 de la dose initiale.
4. À l'avenir, vous devriez viser un ratio Ca:Mg de 1:4. Veuillez lire le chapitre sur la fertilisation à ce sujet.
D.3. RHODOPHYTA SP. 3

Cette algue est liée à un déséquilibre entre le Ca et le Mg où il y a trop de Mg.
Si vous avez du marbre dans votre bac, il devra être retiré.
1. Utilisez le protocole générique KNO3
2. À l'avenir, réduisez les apports en Mg.
D.4. RHODOPHYTA LEMANEA (BBA, algues pinceaux noires):

Le manque de CO2 et une concentration trop importante en Ca sont liés à la prolifération de cette algue. Parfois, un KH élevé est en cause.
1. Utilisez le protocole générique KNO3
2. Vérifiez votre KH, éventuellement, réduisez le KH en utilisant de l'eau osmosée.
3. Vérifiez votre concentration en CO2. Lisez le chapitre sur le CO2.
D.5. RHODOPHYTA SP. 5

Cette algue est liée à un déséquilibre entre les NO3 et PO4 avec un excès de PO4 et un manque de CO2.
1. Utilisez le protocole générique KNO3
2. Vérifiez votre KH, éventuellement, réduisez le KH en utilisant de l'eau osmosée.
3. Vérifiez votre concentration en CO2. Lisez le chapitre sur le CO2.
4. Arrêtez d'ajouter des PO4, référez vous au chapitre dédié ci-dessus.
E. DIATOMÉE (algues marrons)

Augmentez la puissance d'éclairage !!!!!! Ne perdez pas votre temps avec les silicates.
F. ALGUES FILAMENTEUSES BRUNES

Cette algue est liée à un excès de soufre. Cela se produit généralement lorsque l'eau du robinet contient déjà trop de soufre.
1. Utilisez le protocole générique KNO3
2. Essayez d'obtenir une analyse de votre eau du robinet
3. Réduire voir stopper l'utilisation de sulfates (potassium, Mg, etc.)
G. Différentes algues en même temps
Vous devrez choisir la plus néfaste et commencer à travailler à son élimination. La cyano est la pire parce qu'elle tue les plantes.
Si vous vous approchez de l'apparition des GSA, cette chimie de l'eau vous aidera à trouver un équilibre à long terme.
LES DÉSÉQUILIBRES CONTRÔLÉS
Dans ce chapitre, je vais décrire le protocole (par étapes) que j'ai utilisé avec succès pour dans un premier temps modifier l'équilibre de l'aquarium pour faire apparaitre les GSA, et dans un second temps pour trouver un équilibre durable sans aucune algue.
A. LES ALGUES VERTES
A.1. L'EAU VERTE

Les causes du développement de cette algue ne sont pas clairement identifiées. Dans ce que j'ai pu observer, elle se développe toujours lorsque les niveaux de NO3 et de PO4 sont élevés simultanément. Cependant, il semble que ce ne soit pas la seule situation dans laquelle elle se développe. L'eau verte est fréquente peu après la mise en route d'un bac, nous pouvons émettre l'hypothèse que les nitrites peuvent également être consommés par cette algue.
Les changements d'eau n'y changeront rien, généralement c'est même pire après.
Pour éviter l'eau verte, le mieux est de mettre en place dans le nouvel aquarium de nombreuses plantes à croissance rapide, même s'il ne s'agit pas des espèces que vous garderez ensuite dans le bac.
Elle peut être stoppée en utilisant pour du Tetra Bactozym (il s'agit de gélules accélérant la colonisation des filtres par les bactéries "utiles").
Un filtre UV est la meilleure solution. Faire un changement d'eau de 50% à la mise en route du tube UV et renouveler ce changement à J7. Arrêtez de fertiliser durant le traitement.
A.2. GREEN STRING ALGAE (GSA)
Cette algue est liée à la présence d'ammoniaque. Il convient de vous référer à la section sur la qualité de l'eau afin d'identifier l'origine de cette substance dans votre bac.
PROTOCOLE
1. J1, changer 50 % de l'eau de votre bac. Vérifiez que l'eau que vous ajoutez est exempte d'ammoniaque.
2. Ne pas diminuez la puissance de votre éclairage.
3. Vérifiez la concentration en CO2.
4. Ajouter directement au niveau des algues avec une seringue sans aiguille 10 ml / 25 gallons (95 litres) de peroxyde d'hydrogène, le glutaraldéhyde (Flourish Excel) peut également être utilisé. Cependant, ces produits tuent les algues mais ne traite pas la cause .
5. Arrêtez la fertilisation en cours.
6. Ajouter 1 gramme de KNO3 pour 50 gallons (190 litres) par jour.
7. J7, changer 50 % de l'eau de votre bac.
Si vous avez suffisamment de crevettes, ces dernières peuvent facilement manger cette algue, mais cela ne résoudra pas le déséquilibre qui a causé sa prolifération. 1 crevette par litre peuvent nettoyer un bac en deux jours. C'est une solution facile si vous en avez déjà ou si elles sont bon marché. Là où je vis un sac de 200 crevettes coûte environ 2 dollars (c'est injuste
 ), elles sont utilisées comme nourriture vivante.
), elles sont utilisées comme nourriture vivante.A.3. Sp. SHORT GREEN ALGAE

J'ai été affecté par cette algue entre le moment où j'ai vendu mon ancien filtre et celui où j'ai reçu le nouveau. Mon aquarium a beaucoup d'échinodorus et quelques plantes à croissance rapide. Une semaine après l'installation du nouveau filtre et après ajout de plantes supplémentaires, cette algue a disparu.
A.4. GREEN SPOT ALGAE (GSA)

La GSA est liée à un déséquilibre entre les PO4 et les NO3. Globalement, il n'y a pas de PO4.
PROTOCOLE:
1. J1, changer 50 % de l'eau de votre bac.
2. Continuez à ajouter du KNO3.
3. Nettoyez les GSA sur les vitres quotidiennement.
4. Ajouter quotidiennement 1 gramme de PO4 tous les 500 gallons (1900 litres) jusqu'à ce que les GSA n'apparaissent plus.
5. Dès que vous atteignez ce point ou à J7, changer 50 % de l'eau.
6. Si la GSA n'a pas arrêté de proliférer la première semaine, après le changement d'eau, doubler la quantité de KNO3 pendant la deuxième semaine et ainsi de suite.
A.5. CLADOPHORA

Cette algue est liée à un déséquilibre entre l'éclairage et le CO2.
Vérifiez votre concentration en CO2. Lisez le chapitre sur le CO2 pour en savoir plus sur la quantité qui peut être difusée sans risquer votre faune. S'il n'y a aucun moyen d'ajouter plus de CO2, vous devriez diminuer l'éclairage. Cela pourrait se produire lorsque le bac est exposé à la lumière naturelle en été.
Vous pouvez utiliser du Flourish Excel pour tuer cette algue, en ajoutant 4 fois la dose recommandée.
Si vous avez des crevettes dans votre bac et que vous ne voulez prendre le risque d'ajouter plus de CO2, vous pouvez compenser en utilisant du Flourish Excel et du CO2.
Les Riccia, Egeria densa et hemianthus micrantemoides souffrent beaucoup des surdosages en Flourish Excel.
PROTOCOLE
1. Vérifiez le niveau de CO2.
2. Utilisez le protocole générique KNO3
3. Ajoutez 4 fois la dose recommandée en Flourish Excel
B. BGA: CYANOBACTÉRIE (OSCILLIOTA SPLENDENS)

Les cyanobactéries sont liées à un déséquilibre entre le NO3 et le PO4. Cela signifie qu'il y a trop de PO4, ou peut survenir lorsqu'il n'y a plus de NO3.
Si vous avez des discus, le problème est probablement lié à un excès de PO4.
Si vous avez un tapis de glossostigma elatinoides alors le problème vient probablement de l'absence de NO3.
Les cyanobactéries peuvent être éliminées de la même manière que les bactéries. Vous pouvez ajouter directement au niveau des algues avec une seringue sans aiguille 10 ml / 25 gallons (95 litres) de peroxyde d'hydrogène une fois par jour. L'érythromycine peut être utilisée seulement quand vous avez trop de cyano.
PROTOCOLE 1
Si la cyano est en faible quantité, sa prolifération est probablement causée par l'absence de NO3. Cela arrive généralement lorsque vous avez des glossostigma elatinoides ou beaucoup de plantes à croissance rapide.
1. Utilisez le protocole générique KNO3.
2. Siphonnez les cyanobactéries ou utilisez du peroxyde d'hydrogène.
PROTOCOLE 2
1. Utilisez le protocole générique KNO3 mais doublez la quantité de KNO3.
2. Plonger l'aquarium complétement dans le noir (black-out) pendant 3 jours.
3. Après les 3 jours, redémarrez le protocole générique KNO3 avec la quantité standard de KNO3 jusqu'à l'apparition de GSA.
PROTOCOLE 3
1. Utilisez le protocole générique KNO3 mais doublez la quantité de KNO3.
2. Plonger l'aquarium complétement dans le noir (black-out) pendant 3 jours.
3. Ajoutez 500 mg d'érythromycine pour 25 gallons (95 litres) une fois par jour.
4. Après 3 jours, redémarrez le protocole générique KNO3 avec la quantité standard de KNO3 jusqu'à l'apparition de GSA.
C. GREEN DUST ALGAE (GDA)

Il y a beaucoup de confusions à propos de cette algue. La méthode EI suggère d'attendre la fin du cycle de vie de cette algue (3 semaines).
Cependant, un de mes amis a attendu 6 mois, la photo provient de son bac.
J'ai testé l'eau et j'ai découvert un déséquilibre complexe lié à 1) au ratio Ca:Mg, le Ca étant en excès et 2) NO3:PO4, les PO4 étant en excès également.
Trois jours plus tard, après avoir travaillé sur ces déséquilibres, le problème a été résolu.
PROTOCOLE:
1. Utilisez le protocole générique KNO3
2. Nettoyez les vitres tous les jours jusqu'à ce que les GDA n'apparaissent plus.
3. À l'avenir, vous devriez viser un ratio Ca:Mg de 1:4.
4. Si vous ajoutez PO4, lisez le chapitre dédié sur les PO4.
5. Lisez également le chapitre sur la qualité de l'eau à propos des excès de PO4 et de Ca dans l'eau du robinet.
D.1. RHODOPHYTA SP.1
Cette algue est liée à un excès de Fe.

1. Utilisez le protocole générique KNO3
2. Ajoutez directement sur les algues avec une seringue sans aiguille 10 ml / 25 gallons (95 litres) de peroxyde d'hydrogène une fois par jour. Le Flourish Excel peut également être utilisé, à 4 fois la dose recommandée.
3. À l'avenir, vous devrez baisser vos apports de Fer en apportant 1/3 de la dose initiale.
D.2. RHODOPHYTA SP. 2

Cette algue est liée à un déséquilibre complexe avec un excès de Ca par rapport au Mg, avec également un excès de Fe.
1. Utilisez le protocole générique KNO3
2. Ajoutez directement sur les algues avec une seringue sans aiguille 10 ml / 25 gallons (95 litres) de peroxyde d'hydrogène une fois par jour. Le Flourish Excel peut également être utilisé, à 4 fois la dose recommandée.
3. À l'avenir, vous devrez baisser vos apports de Fer en apportant 1/3 de la dose initiale.
4. À l'avenir, vous devriez viser un ratio Ca:Mg de 1:4. Veuillez lire le chapitre sur la fertilisation à ce sujet.
D.3. RHODOPHYTA SP. 3

Cette algue est liée à un déséquilibre entre le Ca et le Mg où il y a trop de Mg.
Si vous avez du marbre dans votre bac, il devra être retiré.
1. Utilisez le protocole générique KNO3
2. À l'avenir, réduisez les apports en Mg.
D.4. RHODOPHYTA LEMANEA (BBA, algues pinceaux noires):

Le manque de CO2 et une concentration trop importante en Ca sont liés à la prolifération de cette algue. Parfois, un KH élevé est en cause.
1. Utilisez le protocole générique KNO3
2. Vérifiez votre KH, éventuellement, réduisez le KH en utilisant de l'eau osmosée.
3. Vérifiez votre concentration en CO2. Lisez le chapitre sur le CO2.
D.5. RHODOPHYTA SP. 5

Cette algue est liée à un déséquilibre entre les NO3 et PO4 avec un excès de PO4 et un manque de CO2.
1. Utilisez le protocole générique KNO3
2. Vérifiez votre KH, éventuellement, réduisez le KH en utilisant de l'eau osmosée.
3. Vérifiez votre concentration en CO2. Lisez le chapitre sur le CO2.
4. Arrêtez d'ajouter des PO4, référez vous au chapitre dédié ci-dessus.
E. DIATOMÉE (algues marrons)

Augmentez la puissance d'éclairage !!!!!! Ne perdez pas votre temps avec les silicates.
F. ALGUES FILAMENTEUSES BRUNES

Cette algue est liée à un excès de soufre. Cela se produit généralement lorsque l'eau du robinet contient déjà trop de soufre.
1. Utilisez le protocole générique KNO3
2. Essayez d'obtenir une analyse de votre eau du robinet
3. Réduire voir stopper l'utilisation de sulfates (potassium, Mg, etc.)
G. Différentes algues en même temps
Vous devrez choisir la plus néfaste et commencer à travailler à son élimination. La cyano est la pire parce qu'elle tue les plantes.
Si vous vous approchez de l'apparition des GSA, cette chimie de l'eau vous aidera à trouver un équilibre à long terme.
 waliounConseiller
waliounConseiller
 Nombre de messages : 4276
Nombre de messages : 4276
Age : 88
Localisation : 06110 Bassin Cannois
Emploi : retraité
Date d'inscription : 08/08/2012
 Re: La méthode des déséquilibres controlés
Re: La méthode des déséquilibres controlés
Sam 23 Déc 2017 - 12:14
Salut,
Si c'est écrit à l'encre sympathique, il faut nous donner le réactif !....
Si c'est écrit à l'encre sympathique, il faut nous donner le réactif !....

_________________
Cordialement
Henri,
Mon Rio 180

 alexv95Spécialiste plantes
alexv95Spécialiste plantes
 Nombre de messages : 3171
Nombre de messages : 3171
Localisation : Val d'Oise
Emploi : Jardinier aquatique
Date d'inscription : 10/11/2012
 Re: La méthode des déséquilibres controlés
Re: La méthode des déséquilibres controlés
Sam 23 Déc 2017 - 12:32
Le réactif est en cours d'application mais l'effet n'est pas très rapide 

 Stan78Membre : Occasionnel
Stan78Membre : Occasionnel
 Nombre de messages : 90
Nombre de messages : 90
Localisation : Le Chesnay
Emploi : -
Date d'inscription : 16/01/2017
 Re: La méthode des déséquilibres controlés
Re: La méthode des déséquilibres controlés
Sam 23 Déc 2017 - 14:09
Alors là c'est vache, article super intéressant, le désir monte et hop, finalement vous l'aurez pour les étrennes. 
(edit : l'encre au jus de citron a été révélé)

(edit : l'encre au jus de citron a été révélé)
 Yann vialleMembre : Accro
Yann vialleMembre : Accro
 Nombre de messages : 2146
Nombre de messages : 2146
Localisation : Valence
Emploi : Chimiste
Date d'inscription : 07/09/2017
 Re: La méthode des déséquilibres controlés
Re: La méthode des déséquilibres controlés
Lun 25 Déc 2017 - 9:23
J'attends avec impatience la suite, l'article est riche de réflexion, et permettra sûrement à beaucoup de se poser des questions sur leur méthode de fertilisation.
En tous cas merci Alex pour ce travail de traduction, c'est très facile à lire.
En tous cas merci Alex pour ce travail de traduction, c'est très facile à lire.
 Cory29Membre : Accro
Cory29Membre : Accro
 Nombre de messages : 2408
Nombre de messages : 2408
Localisation : Finistère
Emploi : Retraité contrôle des populations (tueur à gages)
Date d'inscription : 18/05/2014
 Re: La méthode des déséquilibres controlés
Re: La méthode des déséquilibres controlés
Lun 25 Déc 2017 - 11:49
Article très intéressant.
J'apporterais un petit bémol concernant la relation 1W/1litre, le watt est une unité de puissance et non d'éclairement, il aurait mieux valu parler de lumens ou lux. Le watt ne veut pas dire grand chose, pour une même puissance les leds et les néons ne donnent pas le même résultat en flux lumineux.
J'apporterais un petit bémol concernant la relation 1W/1litre, le watt est une unité de puissance et non d'éclairement, il aurait mieux valu parler de lumens ou lux. Le watt ne veut pas dire grand chose, pour une même puissance les leds et les néons ne donnent pas le même résultat en flux lumineux.
 Yann vialleMembre : Accro
Yann vialleMembre : Accro
 Nombre de messages : 2146
Nombre de messages : 2146
Localisation : Valence
Emploi : Chimiste
Date d'inscription : 07/09/2017
 Re: La méthode des déséquilibres controlés
Re: La méthode des déséquilibres controlés
Lun 25 Déc 2017 - 22:18
Oui mais l'article d'origine date de 2010, donc le standard a l'époque était le néon. Même si les leds commençaient à percer.
Et puis ça donne un ordre d'idée. La lumière n'est pas son point cible, il dis plutôt qu'il faut déjà une bonne luminosité avant de regarder le reste.
Dites moi si j'ai tords, jetait encore tous jeune aquariophile en ce temps.
Et puis ça donne un ordre d'idée. La lumière n'est pas son point cible, il dis plutôt qu'il faut déjà une bonne luminosité avant de regarder le reste.
Dites moi si j'ai tords, jetait encore tous jeune aquariophile en ce temps.
_________________
Instagram : https://www.instagram.com/planted__life/
 Re: La méthode des déséquilibres controlés
Re: La méthode des déséquilibres controlés
Mar 26 Déc 2017 - 0:52
Sauf, que je remet en cause sérieusement cette méthode.
Ce n’est que construction approximative, voir invention.
Il ne cite strictement aucune source scientifique pour étayer ses dires.
Il ne cite aucune source et référence scientifique fiable.
Il ne cite aucune source et référence scientifique fiable.
Il ne cite aucune source et référence scientifique fiable.
Il a volé les connaissances d’autres !
Il a la malhonnêteté de ne pas citer les articles scientifiques qui en parlent bien avant lui !
Il y a des JE JE JE JE JE, toutes les 3 lignes.
Quel truand !.
Technique de menteur patenté.
S’approprier quelque chose, qui n’est pas à soi !
Je vais m’arrêter là, car je pourrais démonter un par un, quasiment tout.
Ce fameux Christian Rubilar, est une sacrée ordure manipulatrice, dont tu ferais mieux de te méfier comme la peste. Il utilise tout un champ lexical et grammatical, que je connais très bien : la manipulation. Piquer des idées aux autres pour se les approprier, et ensuite combler les « blancs » (comme « les auteurs ») pour ne dire que c’est de l’invention totale.
Moteur de recherche des articles scientifiques.
https://scholar.google.fr/
J’ai trouvé des articles scientifique de 1901 sur les PO4, NO3, KNO3, Fe sur les plantes aquatiques !
Tranquillou ses trouvailles révolutionnaires…. datant de 1 siècle ?
Sa méthode :
http://wiki.infopez.com/index.php/Sistema_de_Abonado_MDC_%22M%C3%A9todo_de_los_Desequilibrios_Controlados%22
Elles sont ou, les références et articles scientifiques en bas de pages ?
Il n’y a que des références de forums aquariophiles , en papotage !
Bah putain, ca c’est de la référence de qualité !
https://www.forumaquario.org/t114439-maintenance-conseils-pour-corydoras#1565779
Tu les vois mes citations scientifiques ?
Moi , quand je dis que les Aspidoras sont principalement insectivores, je ne l’invente pas, et je ne vole pas le savoir des autres. Je cite l’article scientifique de références pour que tout le monde puisse vérifier, discuter ou approfondir.
https://www.forumaquario.org/t114439-maintenance-conseils-pour-corydoras#1484201
Tu les vois mes citations/références scientifiques en bas?
Tu vois la différence entre moi et lui ?
https://fr.wikipedia.org/wiki/Nitrate
Tu les vois mes 89 citations/références scientifiques en bas?
Tu vois la différence entre wikipédia sourcé et lui ?
Ce qu’il a fait, et c’est très à la mode dans le petit monde aquascaping : inventer des trucs, qu’ils ont repiqué à d’autres, pour se faire du pognon et se rendre intéressant.
Le dernier en date : le Twinstar
https://www.aquachange.fr/forum_aquariophilie.php?groupe=8&sujet=618
eb.aquario.passion, c’est moi sur aquachange. J’ai démoli, avec preuves à l’appui, que la réaction que fait le twinstar soi-disant révolutionnaire date de 1891 !!! Et ca, le twinstar a été 2-3 invéntés/co-actionné (actionnariat d'entreprise) par 3 allemands aquascapeur ayant pignon sur rue. Sauf que ce soit les 3 plus beaux enculeurs que le monde aquascape aient connu ! Sur le papier, la réaction d’oxyde radicaux se fait pour moins de 10 Euros. Et eux, on vendu le twinstar 180 Euros, et 55 euros la recharge !
Ca va, tranquillou, l’enculomètre ?
Ca va, tranquillou, le vol scientifique ?
Ca va, tranquillou, le mensonge commerciale ?
Ca va, tranquillou, le vol de droit d’auteur ?
Ton Christian Rubilar, fait exactement la même chose, à la virgule prêt.
Ton Christian Rubilar, est un MENTEUR, MANIPULATEUR ET MALHONNETE
Je te le remet : https://scholar.google.fr/
Il a piqué des connaissances scientifiques, à d’autres, et parfois de plus d’un siècle.
En plus d'inventer, pour faire croire à une nouveauté miracle.
Ce n’est que construction approximative, voir invention.
Il ne cite strictement aucune source scientifique pour étayer ses dires.
Technique habituelle de manipulation. Pour se dedouaner d’une invention, on met au crédit d’autres. Et surtout, surtout, surtout, surtout, ne jamais citer les auteurs scientifiques, sinon, cela casserait toute la pyramide.de nombreux auteurs affirment que certaines algues prolifèrent à cause d'excès de NO3 ou de PO4.
Il ne cite aucune source et référence scientifique fiable.
Encore des affirmations non étayées, voir complètement inventées.D'un autre côté, la méthode EI (il s'agit de la méthode de Tom Barr mais elle est peu utilisé sur forumaquario) affirme que les algues prolifèrent à cause du manque de CO2, de lumière ou de fertilisation. L'idée est bien orientée, mais incomplète.
Il ne cite aucune source et référence scientifique fiable.
Encore des affirmations non étayées, voir complètement inventées.À propos du manque de nutriments, la méthode EI affirme que les algues prolifèrent à cause d'un carence d'un nutriment et proposent d'ajouter cet élément macro/micro pour résoudre le problème. Je ne suis pas d'accord avec cette approche. Dans les pages suivantes, je vais vous expliquer pourquoi.
Il ne cite aucune source et référence scientifique fiable.
Il n’a rien découvert !J'ai découvert que lorsque le Co2 et la Lumière sont assez élevés et que vous avez un problème d'algue, cela est lié à un déséquilibre entre les nutriments après absorption.
Il a volé les connaissances d’autres !
Il a la malhonnêteté de ne pas citer les articles scientifiques qui en parlent bien avant lui !
Il y a des JE JE JE JE JE, toutes les 3 lignes.
Quel truand !.
Technique fallacieuse.Je l'ai associé avec du PO4, du KNO3, du Fe, etc. afin de provoquer une prolifération d'algues.
J'ai découvert qu'il existe une relation entre certains déséquilibres et certaines algues. D'un autre côté, lorsque j'ai essayé la solution proposée par la méthode EI et d'autres méthodes, elles n'ont tout simplement pas fonctionné.
Technique de menteur patenté.
S’approprier quelque chose, qui n’est pas à soi !
Je vais m’arrêter là, car je pourrais démonter un par un, quasiment tout.
Ce fameux Christian Rubilar, est une sacrée ordure manipulatrice, dont tu ferais mieux de te méfier comme la peste. Il utilise tout un champ lexical et grammatical, que je connais très bien : la manipulation. Piquer des idées aux autres pour se les approprier, et ensuite combler les « blancs » (comme « les auteurs ») pour ne dire que c’est de l’invention totale.
Moteur de recherche des articles scientifiques.
https://scholar.google.fr/
J’ai trouvé des articles scientifique de 1901 sur les PO4, NO3, KNO3, Fe sur les plantes aquatiques !
Tranquillou ses trouvailles révolutionnaires…. datant de 1 siècle ?
Sa méthode :
http://wiki.infopez.com/index.php/Sistema_de_Abonado_MDC_%22M%C3%A9todo_de_los_Desequilibrios_Controlados%22
Elles sont ou, les références et articles scientifiques en bas de pages ?
Il n’y a que des références de forums aquariophiles , en papotage !
Bah putain, ca c’est de la référence de qualité !
https://www.forumaquario.org/t114439-maintenance-conseils-pour-corydoras#1565779
Tu les vois mes citations scientifiques ?
Moi , quand je dis que les Aspidoras sont principalement insectivores, je ne l’invente pas, et je ne vole pas le savoir des autres. Je cite l’article scientifique de références pour que tout le monde puisse vérifier, discuter ou approfondir.
https://www.forumaquario.org/t114439-maintenance-conseils-pour-corydoras#1484201
Tu les vois mes citations/références scientifiques en bas?
Tu vois la différence entre moi et lui ?
https://fr.wikipedia.org/wiki/Nitrate
Tu les vois mes 89 citations/références scientifiques en bas?
Tu vois la différence entre wikipédia sourcé et lui ?
Ce qu’il a fait, et c’est très à la mode dans le petit monde aquascaping : inventer des trucs, qu’ils ont repiqué à d’autres, pour se faire du pognon et se rendre intéressant.
Le dernier en date : le Twinstar
https://www.aquachange.fr/forum_aquariophilie.php?groupe=8&sujet=618
eb.aquario.passion, c’est moi sur aquachange. J’ai démoli, avec preuves à l’appui, que la réaction que fait le twinstar soi-disant révolutionnaire date de 1891 !!! Et ca, le twinstar a été 2-3 invéntés/co-actionné (actionnariat d'entreprise) par 3 allemands aquascapeur ayant pignon sur rue. Sauf que ce soit les 3 plus beaux enculeurs que le monde aquascape aient connu ! Sur le papier, la réaction d’oxyde radicaux se fait pour moins de 10 Euros. Et eux, on vendu le twinstar 180 Euros, et 55 euros la recharge !
Ca va, tranquillou, l’enculomètre ?
Ca va, tranquillou, le vol scientifique ?
Ca va, tranquillou, le mensonge commerciale ?
Ca va, tranquillou, le vol de droit d’auteur ?
Ton Christian Rubilar, fait exactement la même chose, à la virgule prêt.
Ton Christian Rubilar, est un MENTEUR, MANIPULATEUR ET MALHONNETE
Je te le remet : https://scholar.google.fr/
Il a piqué des connaissances scientifiques, à d’autres, et parfois de plus d’un siècle.
En plus d'inventer, pour faire croire à une nouveauté miracle.
_________________
A un moment, la beauté d'un poisson doit arrêter être visuelle. C'est de l'égocentrisme. Mais tout simplement qu'il vive sa vie en harmonie dans son milieu, même si le milieu ou poisson est moins beau. Juste pour le plaisir de s'en occuper tout simplement. Il vaut mieux aller dans le sens de Mère-Nature.Telle est ma philosophie !
Chaine Youtube
3000L+ d'aquariums
Album photos Flickr
 alexv95Spécialiste plantes
alexv95Spécialiste plantes
 Nombre de messages : 3171
Nombre de messages : 3171
Localisation : Val d'Oise
Emploi : Jardinier aquatique
Date d'inscription : 10/11/2012
 Re: La méthode des déséquilibres controlés
Re: La méthode des déséquilibres controlés
Mar 26 Déc 2017 - 12:01
@ Horlack : Pour te répondre, j'avais prévu de faire un post à la fin de la traduction pour donner mon avis sur la méthode. Dans la vie, je travaille à l'Anses, sur l'évaluation scientifique des produits phytopharmaceutiques avant leur mise sur le marché, et nous tentons effectivement d'avoir une évaluation scientifique la plus transparente possible (même si ce n'est pas toujours reconnu comme tel, surtout sur une thématique si médiatique en ce moment).
Donc je suis d'accord avec toi, l'auteur est très égocentrique et ne semble pas être habitué à la rédaction d'articles scientifiques, la partie bibliographie étant réduite à néant. Cependant, si on veut être transparent il faut poser tous les arguments sur la table, qu'ils nous plaisent ou non. Rentrer dans leur jeu en étant manichéen, en les démolissant unilatéralement justement comme ils le font avec les autres concurrents, cela ne nous aidera pas à avancer sur notre problématique des bacs plantés. Je pense donc qu'il faut aller au delà sans tout prendre pour argent comptant.
Tu noteras également que sauf maladresse de ma part, je n'ai pas tenté de m'approprier les connaissances ni le nom de l'auteur, ce n'est pas "mon Christian Rubilar" comme tu le dis, je reprends son nom puisque je traduis l'article qu'il a écrit et je ne compte pas m'approprier son compte-tenu. Si l'impression qui ressort de ma traduction montre une certaine forme d'idolâtrie envers l'auteur, ce n'est pas mon intention et n'hésite pas à m'indiquer où cela transparait que je puisse corriger la forme de mon post.
Alors pourquoi donc ai-je choisi cet article? Depuis plusieurs années, je tente avec plus ou moins de réussite de faire des bacs très plantés. Si on s'intéresse aux différentes méthodes proposées, on notera qu'elles sont peu nombreuses et surtout, sauf erreur de ma part, qu'aucune n'est étayée sur le plan scientifique. Pourquoi ? Le gens ne sont pas forcément malhonnête mais nous sommes sur un hobby où les enjeux sont marginaux à l'échelle de la société. Sur tous les pratiquants, qui dispose réellement de matériel de laboratoire pour réaliser des tests avec une méthodologie robuste ?
La seule personne qui communique beaucoup sur sa méthode est Tom Barr et là aussi l'argumentation scientifique est très peu étayée et le personnage semble très égocentrique.
Nous en sommes donc réduit à rassembler les morceaux de différents forum pour tenter de se faire un bac planté avec une méthode qui tiennent la route. Même si les personnes qui postent des conseils sont je pense très honnêtes, il y a effectivement de nombreuses erreurs d'interprétation, de généralisation, d'extrapolation et de mélanges qui empêche d'avoir un ensemble cohérent et qui fonctionne. Pour moi en tout cas ça n'a pas marché, j'ai eu de bons résultats mais trop éphémères, les algues finissaient toujours par apparaitre et j'étais très perplexe face aux solutions proposées (attendre, changer de l'eau, moins nourrir, baisser la lumière et les engrais... On retrouve ces conseils quelque soit le type d'algues que l'on a et leur mise en pratique ne s'est jamais révélé très efficace chez moi. Ces conseils me semble très arbitraires). J'ai eu le coup des filamenteuses vertes, qui d'après ce que j'avais pu lire ici et là était signe d'un bac bien équilibré. Ravi de l'apprendre mais les algues se sont développés dans tous le bac, entrainant la mort des plantes et de certains poissons. Si j'avais souhaité cultiver des filamenteuses vertes, je m'y serais pris autrement...
Voilà pourquoi la méthode m'intéresse, depuis que je l'ai mise en pratique, je l'ai adapté différemment mais j'ai conservé le principe de base (je détaillerai dans un autre post ci-dessous ce que j'ai fait ou observé, je vais d'abord terminer la traduction), elle fonctionne chez moi et les retours sur les forums que j'ai pu lire sont bons. Alors, même si la construction scientifique est peu robuste (voir nulle) et que l'auteur fait part d'un égocentrisme certain, à défaut de mieux, je m'en contente et je prends ce qui m'intéresse .
.
Donc je suis d'accord avec toi, l'auteur est très égocentrique et ne semble pas être habitué à la rédaction d'articles scientifiques, la partie bibliographie étant réduite à néant. Cependant, si on veut être transparent il faut poser tous les arguments sur la table, qu'ils nous plaisent ou non. Rentrer dans leur jeu en étant manichéen, en les démolissant unilatéralement justement comme ils le font avec les autres concurrents, cela ne nous aidera pas à avancer sur notre problématique des bacs plantés. Je pense donc qu'il faut aller au delà sans tout prendre pour argent comptant.
Tu noteras également que sauf maladresse de ma part, je n'ai pas tenté de m'approprier les connaissances ni le nom de l'auteur, ce n'est pas "mon Christian Rubilar" comme tu le dis, je reprends son nom puisque je traduis l'article qu'il a écrit et je ne compte pas m'approprier son compte-tenu. Si l'impression qui ressort de ma traduction montre une certaine forme d'idolâtrie envers l'auteur, ce n'est pas mon intention et n'hésite pas à m'indiquer où cela transparait que je puisse corriger la forme de mon post.
Alors pourquoi donc ai-je choisi cet article? Depuis plusieurs années, je tente avec plus ou moins de réussite de faire des bacs très plantés. Si on s'intéresse aux différentes méthodes proposées, on notera qu'elles sont peu nombreuses et surtout, sauf erreur de ma part, qu'aucune n'est étayée sur le plan scientifique. Pourquoi ? Le gens ne sont pas forcément malhonnête mais nous sommes sur un hobby où les enjeux sont marginaux à l'échelle de la société. Sur tous les pratiquants, qui dispose réellement de matériel de laboratoire pour réaliser des tests avec une méthodologie robuste ?
La seule personne qui communique beaucoup sur sa méthode est Tom Barr et là aussi l'argumentation scientifique est très peu étayée et le personnage semble très égocentrique.
Nous en sommes donc réduit à rassembler les morceaux de différents forum pour tenter de se faire un bac planté avec une méthode qui tiennent la route. Même si les personnes qui postent des conseils sont je pense très honnêtes, il y a effectivement de nombreuses erreurs d'interprétation, de généralisation, d'extrapolation et de mélanges qui empêche d'avoir un ensemble cohérent et qui fonctionne. Pour moi en tout cas ça n'a pas marché, j'ai eu de bons résultats mais trop éphémères, les algues finissaient toujours par apparaitre et j'étais très perplexe face aux solutions proposées (attendre, changer de l'eau, moins nourrir, baisser la lumière et les engrais... On retrouve ces conseils quelque soit le type d'algues que l'on a et leur mise en pratique ne s'est jamais révélé très efficace chez moi. Ces conseils me semble très arbitraires). J'ai eu le coup des filamenteuses vertes, qui d'après ce que j'avais pu lire ici et là était signe d'un bac bien équilibré. Ravi de l'apprendre mais les algues se sont développés dans tous le bac, entrainant la mort des plantes et de certains poissons. Si j'avais souhaité cultiver des filamenteuses vertes, je m'y serais pris autrement...
Voilà pourquoi la méthode m'intéresse, depuis que je l'ai mise en pratique, je l'ai adapté différemment mais j'ai conservé le principe de base (je détaillerai dans un autre post ci-dessous ce que j'ai fait ou observé, je vais d'abord terminer la traduction), elle fonctionne chez moi et les retours sur les forums que j'ai pu lire sont bons. Alors, même si la construction scientifique est peu robuste (voir nulle) et que l'auteur fait part d'un égocentrisme certain, à défaut de mieux, je m'en contente et je prends ce qui m'intéresse
 Re: La méthode des déséquilibres controlés
Re: La méthode des déséquilibres controlés
Mar 26 Déc 2017 - 13:12
L'egocentrisme...ca a l'air d'être une chienlit chez les aquascapeurs...
J'ai bien compris que ce n'était pas toi, mais Christian Rubila.
L'impression des forums aquariophiles est le pire ennemi qui soit.
Les erreurs ou hold-up scientifique en aquariophilie sont legions.
A ce petit jeu, et je l'ai démontré sur le domaine des Corydoras : Seul 3 corydoras étaient à peut-prêt connu (pygmaeus/aeneus/paleatus) voici 30 ans, puis aquabase a fait un magistral copier/coller sur les 350 autres espèces de corydoras. Tous les sites ont recopier aquabase. Tous les forums en recopier aquabase. Au bout de 30 ans, soit 3 générations aquariophilies, tout le monde croyait dur comme fer, que les paramètres d'eau des corys devaient être ainsi. Sauf que 99.99% ont tous faux. Ce n'a été que de la pure invention, matraquée et recopié/collée pendant 30 ans !
Pas un seul aquariophile, même hobbyste qu'il soit, n'a eu la présence d'esprit de vérifier ce qui était écrit sur les fiches animalières ou de demander les sources scientifiques.
Et là, je parle en dizaine de milliers d'aquariophilies sur 30 ans, si ce n'est centaine de milliers.
Stop la neuneutophilie !
Stop les hold-up scientifique !
Ce qui se rapproche assez de ma précedente intervention sur "l'impression est l'ennemi du vivant"
https://www.forumaquario.org/t132006p25-questions-concernant-les-feuilles-de-catappa#1578778
https://scholar.google.fr/ moteur de recherche des parutions scientifique existe depuis 20 ans.
Scholar Google référence tous ce qui existe en article scientifique, même les plus anciens qui soit (100-300 ans)
Je le rabâche suffisamment sur forumaquario d'avoir l'esprit critique, alors que la connaissance est maintenant à portée de n'importe qui.
N'importe qui, peut vérifier ce qu'en dit la science.
Qu'on propose de nouvelles idées ou axes, car il y a un trou de connaissance, pourquoi pas.
Mais si la connaissance est là, et de surcroit prétend le contraire depuis 100 ans, de ce que dit une personne , c'est du mensonge et de la mythomanie.
Tu as parfaitement qualifié, Christian Rubila : egocentrisme carabinée. Je rajouterais mythomane patenté.
Que tu prennes plusieurs articles scientifiques sur les plantes aquatiques, et que tu résumes/vulgarises pour les néophytes, tu auras tout mon appui et ma bénédiction.
Chose dont tu devrais être plus ou moins à l'aise, puisque tu es de l'ANSES.
Là, c'est une démarche constructive. C'est apporter une véracité appuyée et démontrée, pour tout le monde.
Il y a une quantité monstrueuse, d'articles scientifiques sur Google Scholar, qui ne méritent que, de sortir de l'ombre, avec des connaissances qui sont tombées dans l'oubli, ou non-sues, ou mal propagées.
A un moment, la complaisance à répéter ce que dit autrui comme un perroquet, ce n'est pas bien-faire. Même si dans la tête de la personne, elle pense bien faire.
Car le résultat est là : 30 ans de mensonges sur les corys répétés et répétés, puis qu'ils ont fini par croire que c’était la vérité, tellement cela a été matraqué et imprimer dans leur tête.
En cerise sur le gâteau final, ou point d'orgue, je peux te garantir qu'au moins 80% de toutes les fiches animalières de poissons sont fausses sur les paramètres d'eau. Elles ont été purement inventées ! Google scholar permet de faire des recherches hydrologiques, mais encore mieux, énormément de base de données hydrologiques ont été rendues publiques avec le GIEC (les problèmes du climat mondial) ces 10 dernières années.. Mon verdict est sans appel : les sites ont purement inventés des quantité monstrueuses de valeurs, car cela devait les faire chier d'avoir des blanc dans leurs fiches animalières.
http://www.fishbase.org/summary/Channa-punctata.html
Fishbase est le seul site, qui dit la vérité la plus absolue qui soit. Si une donnée n'est pas connu, ils ont l’honnêteté, de mettre un point d'interrogation. Ils n'inventent pas. Une grosse majorité des tailles des divers channa ne sont pas connus (courbe de croissance, etc)
Et que fais https://www.fishipedia.fr/poissons/ sur les Channa ?!
Ils annoncent des tailles ! Balèze....d'être plus fort qu'une communauté de scientifique qui ne le savent pas. Encore de l'invention pour combler des trous.
Oui, c'est une manie, et elle perdure encore, même sur les derniers sites à la mode. Cela reste du mensonge et de l'invention.
Fishipedia aurait mis en orange , ou avec une petite asterix, à côté des valeurs non-sures, en disant "attention, valeur non-reconnue et non-prouvée. Valeur communément admise en aquariophile, par impression, et façon empirique", je n'y aurais rien vu à redire. Car là, le lecteur saurait qu'elle est la part d'informations vraie, et la part d'information à prendre avec des pincettes.
Mélanger ces 2 types d'informations sur les sites aquariophiles, est toxique. Car ceux qui les lisent, tel que c'est présenté, croient que c'est la vérité. Alors que c'est potentiellement très faux/inventé/biaisé. Puis au bout de 30 ans, "ce très faux" devient leur vérité.
J'ai bien compris que ce n'était pas toi, mais Christian Rubila.
L'impression des forums aquariophiles est le pire ennemi qui soit.
Les erreurs ou hold-up scientifique en aquariophilie sont legions.
A ce petit jeu, et je l'ai démontré sur le domaine des Corydoras : Seul 3 corydoras étaient à peut-prêt connu (pygmaeus/aeneus/paleatus) voici 30 ans, puis aquabase a fait un magistral copier/coller sur les 350 autres espèces de corydoras. Tous les sites ont recopier aquabase. Tous les forums en recopier aquabase. Au bout de 30 ans, soit 3 générations aquariophilies, tout le monde croyait dur comme fer, que les paramètres d'eau des corys devaient être ainsi. Sauf que 99.99% ont tous faux. Ce n'a été que de la pure invention, matraquée et recopié/collée pendant 30 ans !
Pas un seul aquariophile, même hobbyste qu'il soit, n'a eu la présence d'esprit de vérifier ce qui était écrit sur les fiches animalières ou de demander les sources scientifiques.
Et là, je parle en dizaine de milliers d'aquariophilies sur 30 ans, si ce n'est centaine de milliers.
Stop la neuneutophilie !
Stop les hold-up scientifique !
Ce qui se rapproche assez de ma précedente intervention sur "l'impression est l'ennemi du vivant"
https://www.forumaquario.org/t132006p25-questions-concernant-les-feuilles-de-catappa#1578778
https://scholar.google.fr/ moteur de recherche des parutions scientifique existe depuis 20 ans.
Scholar Google référence tous ce qui existe en article scientifique, même les plus anciens qui soit (100-300 ans)
Je le rabâche suffisamment sur forumaquario d'avoir l'esprit critique, alors que la connaissance est maintenant à portée de n'importe qui.
N'importe qui, peut vérifier ce qu'en dit la science.
Qu'on propose de nouvelles idées ou axes, car il y a un trou de connaissance, pourquoi pas.
Mais si la connaissance est là, et de surcroit prétend le contraire depuis 100 ans, de ce que dit une personne , c'est du mensonge et de la mythomanie.
Tu as parfaitement qualifié, Christian Rubila : egocentrisme carabinée. Je rajouterais mythomane patenté.
Que tu prennes plusieurs articles scientifiques sur les plantes aquatiques, et que tu résumes/vulgarises pour les néophytes, tu auras tout mon appui et ma bénédiction.
Chose dont tu devrais être plus ou moins à l'aise, puisque tu es de l'ANSES.
Là, c'est une démarche constructive. C'est apporter une véracité appuyée et démontrée, pour tout le monde.
Il y a une quantité monstrueuse, d'articles scientifiques sur Google Scholar, qui ne méritent que, de sortir de l'ombre, avec des connaissances qui sont tombées dans l'oubli, ou non-sues, ou mal propagées.
A un moment, la complaisance à répéter ce que dit autrui comme un perroquet, ce n'est pas bien-faire. Même si dans la tête de la personne, elle pense bien faire.
Car le résultat est là : 30 ans de mensonges sur les corys répétés et répétés, puis qu'ils ont fini par croire que c’était la vérité, tellement cela a été matraqué et imprimer dans leur tête.
En cerise sur le gâteau final, ou point d'orgue, je peux te garantir qu'au moins 80% de toutes les fiches animalières de poissons sont fausses sur les paramètres d'eau. Elles ont été purement inventées ! Google scholar permet de faire des recherches hydrologiques, mais encore mieux, énormément de base de données hydrologiques ont été rendues publiques avec le GIEC (les problèmes du climat mondial) ces 10 dernières années.. Mon verdict est sans appel : les sites ont purement inventés des quantité monstrueuses de valeurs, car cela devait les faire chier d'avoir des blanc dans leurs fiches animalières.
http://www.fishbase.org/summary/Channa-punctata.html
Fishbase est le seul site, qui dit la vérité la plus absolue qui soit. Si une donnée n'est pas connu, ils ont l’honnêteté, de mettre un point d'interrogation. Ils n'inventent pas. Une grosse majorité des tailles des divers channa ne sont pas connus (courbe de croissance, etc)
Et que fais https://www.fishipedia.fr/poissons/ sur les Channa ?!
Ils annoncent des tailles ! Balèze....d'être plus fort qu'une communauté de scientifique qui ne le savent pas. Encore de l'invention pour combler des trous.
Oui, c'est une manie, et elle perdure encore, même sur les derniers sites à la mode. Cela reste du mensonge et de l'invention.
Fishipedia aurait mis en orange , ou avec une petite asterix, à côté des valeurs non-sures, en disant "attention, valeur non-reconnue et non-prouvée. Valeur communément admise en aquariophile, par impression, et façon empirique", je n'y aurais rien vu à redire. Car là, le lecteur saurait qu'elle est la part d'informations vraie, et la part d'information à prendre avec des pincettes.
Mélanger ces 2 types d'informations sur les sites aquariophiles, est toxique. Car ceux qui les lisent, tel que c'est présenté, croient que c'est la vérité. Alors que c'est potentiellement très faux/inventé/biaisé. Puis au bout de 30 ans, "ce très faux" devient leur vérité.
_________________
A un moment, la beauté d'un poisson doit arrêter être visuelle. C'est de l'égocentrisme. Mais tout simplement qu'il vive sa vie en harmonie dans son milieu, même si le milieu ou poisson est moins beau. Juste pour le plaisir de s'en occuper tout simplement. Il vaut mieux aller dans le sens de Mère-Nature.Telle est ma philosophie !
Chaine Youtube
3000L+ d'aquariums
Album photos Flickr
 alexv95Spécialiste plantes
alexv95Spécialiste plantes
 Nombre de messages : 3171
Nombre de messages : 3171
Localisation : Val d'Oise
Emploi : Jardinier aquatique
Date d'inscription : 10/11/2012
 Re: La méthode des déséquilibres controlés
Re: La méthode des déséquilibres controlés
Jeu 28 Déc 2017 - 15:55
Bonjour,
J'ai terminé la traduction de la partie méthode, vous pouvez attaquer la lecture pour ceux que ça intéresse . Il me reste à traduire la partie sur les algues.
. Il me reste à traduire la partie sur les algues.
@Horlack : je comprends ta remarque et le sens de ta réflexion mais je vois les choses différemment.
Aller chercher des articles scientifiques c'est une chose, en faire une analyse critique sur la méthodologie, la puissance statistique et identifier les potentiels biais et limites afin de les prendre en compte dans l'interprétation qui sera faite en est une autre. Pour moi, cet exercice n'a rien de facile et ne s'improvise pas, c'est loin d'être à la portée de tout le monde. Il faut être formé à l'analyse critique d'article et également avoir des connaissances solides dans le domaine abordé. Dans le cas présent, je ne pense pas avoir les compétences pour le faire (je n'ai pas de connaissance en écologie ou sur les milieux aquatiques) et je préfère m'abstenir. Je ne critique pas ceux qui le fond, c'est même une très bonne chose je pense, il faut juste bien identifier ses limites (nous en avons tous) et toujours être capable de remettre en question le travail fait. Lorsque nous rendons un rapport à l'Anses, plusieurs dizaines de personnes ont travaillé dessus à son élaboration (chacun sur son domaine de compétence), le travail est validé par d'autres personnes puis ensuite relu par des groupes d'experts. Effectivement les enjeux sont différents et il n'est pas souhaitable d'en arriver là pour l'aquariophilie qui reste un hobby. Mais tout cela pour dire que la rédaction d'un article scientifique de qualité reste complexe.
Ensuite, faire une fiche avec données scientifiques est une bonne chose. Mais à quelle fin ? Si on prend l'exemple des plantes aquatiques (c'est également valable pour les poissons), admettons que je fasse une revue de la littérature sur une plante X qui me dira que cette plante a besoin d'une eau avec tant de calcium, tant de phosphate, qu'il ne faut pas plus de tel concentration en chlorure... Mais en pratique, comment mesure-t-on ses paramètres? Je vais prendre mon test JBL qui me donnera un orange qui correspond à 10 à 20 ppm de nitrates, quoique ce orange est peu être un peu soutenu donc 20 à 40 ppm, je refais le test pour voir, finalement c'est plutôt jaune... Ou pire c'est transparent, je suis donc <0,5 ppm mais ai-je des nitrates dans mon eau?! Un jour, pour tenter d'améliorer la précision des tests, j'ai réalisé une gamme étalon pour les nitrates avec plusieurs solutions à des concentrations correspondant aux valeurs seuils de l'échelle de lecture colorée du test (0,5 ; 1 ; 5 ; 10 et 20). Même si ma méthodologie comportait de nombreuses limites (pureté de la poudre de KNO3 utilisée inconnue, rendement de l'osmoseur utilisé inconnu et variable, balance non calibrée, répétabilité des résultats non vérifiée...), les résultats étaient loin d'être satisfaisant. Tout d'abord, aucune des solutions n'avait la même couleur que celle attendue sur l'échelle. Ensuite, il y avait des incohérence au sein de la gamme elle même, les solutions de 5 et 10 ppm avaient quasiment la même couleur. De même pour les ph-mètre, si vous arrivez à lire une valeur correcte pour plusieurs eaux en bouteille, eau du robinet et solutions étalons dont le pH est connu, indiquez moi où vous avez acheté le votre car avec le mien, j'ai observé des différences de plus d'une unité par rapport au pH attendu (indiqué sur l'étiquette de la bouteille). Si on rapporte ça à la santé humaine, si vous avez une très belle revue de la littérature qui vous montre que l’hypertension artérielle est confirmée si la pression artérielle dépasse 140 mmHg pour la pression systolique ou 9 mmHg pour la pression diastolique mais que les tensiomètres vendus aux médecins ont une précision de +- 20 mmHg, rendant impossible le diagnostic de la pathologie, comment tirer profit de cette information?
Enfin, l'article que j'ai traduit est une méthode, nous sommes sur du multifactoriel et c'est l'une des principales limites des protocoles d'étude aujourd'hui. Mesurer l'évolution d'un seul facteur (le Fe par exemple), avec un équipement de laboratoire approprié, cela est réalisable (sauf avec les tests d'aquariophilie ). Mesurer ensuite l'évolution des concentrations en Fe avec différents niveaux de PO4 rend la démarche beaucoup plus complexe (il faut faire varier les 2 variables en même temps, ce qui augmente de manière exponentielle les opérations à réaliser), avec toutes les variables que l'on retrouve dans un aquarium (nutriments, lumière, bactéries, absorption du sol...) c'est impossible...
). Mesurer ensuite l'évolution des concentrations en Fe avec différents niveaux de PO4 rend la démarche beaucoup plus complexe (il faut faire varier les 2 variables en même temps, ce qui augmente de manière exponentielle les opérations à réaliser), avec toutes les variables que l'on retrouve dans un aquarium (nutriments, lumière, bactéries, absorption du sol...) c'est impossible...
Je ne dis pas qu'il ne faut pas faire de science au contraire mais je pense que compte-tenu des limites actuelles, les méthodes comme celle que j'ai reprise ont leur raison d'être, sans pour autant oublier les limites que cela implique.
J'ai terminé la traduction de la partie méthode, vous pouvez attaquer la lecture pour ceux que ça intéresse
 . Il me reste à traduire la partie sur les algues.
. Il me reste à traduire la partie sur les algues.@Horlack : je comprends ta remarque et le sens de ta réflexion mais je vois les choses différemment.
Aller chercher des articles scientifiques c'est une chose, en faire une analyse critique sur la méthodologie, la puissance statistique et identifier les potentiels biais et limites afin de les prendre en compte dans l'interprétation qui sera faite en est une autre. Pour moi, cet exercice n'a rien de facile et ne s'improvise pas, c'est loin d'être à la portée de tout le monde. Il faut être formé à l'analyse critique d'article et également avoir des connaissances solides dans le domaine abordé. Dans le cas présent, je ne pense pas avoir les compétences pour le faire (je n'ai pas de connaissance en écologie ou sur les milieux aquatiques) et je préfère m'abstenir. Je ne critique pas ceux qui le fond, c'est même une très bonne chose je pense, il faut juste bien identifier ses limites (nous en avons tous) et toujours être capable de remettre en question le travail fait. Lorsque nous rendons un rapport à l'Anses, plusieurs dizaines de personnes ont travaillé dessus à son élaboration (chacun sur son domaine de compétence), le travail est validé par d'autres personnes puis ensuite relu par des groupes d'experts. Effectivement les enjeux sont différents et il n'est pas souhaitable d'en arriver là pour l'aquariophilie qui reste un hobby. Mais tout cela pour dire que la rédaction d'un article scientifique de qualité reste complexe.
Ensuite, faire une fiche avec données scientifiques est une bonne chose. Mais à quelle fin ? Si on prend l'exemple des plantes aquatiques (c'est également valable pour les poissons), admettons que je fasse une revue de la littérature sur une plante X qui me dira que cette plante a besoin d'une eau avec tant de calcium, tant de phosphate, qu'il ne faut pas plus de tel concentration en chlorure... Mais en pratique, comment mesure-t-on ses paramètres? Je vais prendre mon test JBL qui me donnera un orange qui correspond à 10 à 20 ppm de nitrates, quoique ce orange est peu être un peu soutenu donc 20 à 40 ppm, je refais le test pour voir, finalement c'est plutôt jaune... Ou pire c'est transparent, je suis donc <0,5 ppm mais ai-je des nitrates dans mon eau?! Un jour, pour tenter d'améliorer la précision des tests, j'ai réalisé une gamme étalon pour les nitrates avec plusieurs solutions à des concentrations correspondant aux valeurs seuils de l'échelle de lecture colorée du test (0,5 ; 1 ; 5 ; 10 et 20). Même si ma méthodologie comportait de nombreuses limites (pureté de la poudre de KNO3 utilisée inconnue, rendement de l'osmoseur utilisé inconnu et variable, balance non calibrée, répétabilité des résultats non vérifiée...), les résultats étaient loin d'être satisfaisant. Tout d'abord, aucune des solutions n'avait la même couleur que celle attendue sur l'échelle. Ensuite, il y avait des incohérence au sein de la gamme elle même, les solutions de 5 et 10 ppm avaient quasiment la même couleur. De même pour les ph-mètre, si vous arrivez à lire une valeur correcte pour plusieurs eaux en bouteille, eau du robinet et solutions étalons dont le pH est connu, indiquez moi où vous avez acheté le votre car avec le mien, j'ai observé des différences de plus d'une unité par rapport au pH attendu (indiqué sur l'étiquette de la bouteille). Si on rapporte ça à la santé humaine, si vous avez une très belle revue de la littérature qui vous montre que l’hypertension artérielle est confirmée si la pression artérielle dépasse 140 mmHg pour la pression systolique ou 9 mmHg pour la pression diastolique mais que les tensiomètres vendus aux médecins ont une précision de +- 20 mmHg, rendant impossible le diagnostic de la pathologie, comment tirer profit de cette information?
Enfin, l'article que j'ai traduit est une méthode, nous sommes sur du multifactoriel et c'est l'une des principales limites des protocoles d'étude aujourd'hui. Mesurer l'évolution d'un seul facteur (le Fe par exemple), avec un équipement de laboratoire approprié, cela est réalisable (sauf avec les tests d'aquariophilie
 ). Mesurer ensuite l'évolution des concentrations en Fe avec différents niveaux de PO4 rend la démarche beaucoup plus complexe (il faut faire varier les 2 variables en même temps, ce qui augmente de manière exponentielle les opérations à réaliser), avec toutes les variables que l'on retrouve dans un aquarium (nutriments, lumière, bactéries, absorption du sol...) c'est impossible...
). Mesurer ensuite l'évolution des concentrations en Fe avec différents niveaux de PO4 rend la démarche beaucoup plus complexe (il faut faire varier les 2 variables en même temps, ce qui augmente de manière exponentielle les opérations à réaliser), avec toutes les variables que l'on retrouve dans un aquarium (nutriments, lumière, bactéries, absorption du sol...) c'est impossible... Je ne dis pas qu'il ne faut pas faire de science au contraire mais je pense que compte-tenu des limites actuelles, les méthodes comme celle que j'ai reprise ont leur raison d'être, sans pour autant oublier les limites que cela implique.
 alexv95Spécialiste plantes
alexv95Spécialiste plantes
 Nombre de messages : 3171
Nombre de messages : 3171
Localisation : Val d'Oise
Emploi : Jardinier aquatique
Date d'inscription : 10/11/2012
 Re: La méthode des déséquilibres controlés
Re: La méthode des déséquilibres controlés
Jeu 28 Déc 2017 - 16:22
Concernant mon avis sur la méthode, comme je le disais j'ai longtemps eu des problèmes d'algues dans mon bac, pas en permanence mais elles étaient toujours là pour pointer le bout de leur nez de manière imprévue. Je tentais de suivre les conseils recueillis ici et là sur les forums, je fertilisais en respectant le rapport de 10/1 en NO3/PO4 et je complétais avec 16 ppm/semaine de K et des micro en suivant les indications recommandées sur les flacons et en testant mon eau avec les tests JBL.
Puis je suis passé à la fertilisation Tropica, que j'utilise toujours. Les choses se sont bien améliorer (cela a été un peu long au début mais je n'ai pas abandonné et je suis resté assidu). Cependant, quelque chose m'étonnait, les nitrates étaient bien montés d'après les tests (environ 20 ppm) et les phosphates étaient eux non détectables. J'ai au départ compensé les phosphates manquants en tentant d'augmenter la dose. Je me suis retrouvé avec des GSA, j'ai donc ajouté des phosphates (KH2PO4) les GSA ont disparues et... les autres algues sont revenues...
Et j'ai découvert cette méthode. Globalement content de la fertilisation Tropica, je ne voulais pas l'abandonner, j'ai donc "adapté" la méthode à ma manière : j'ai repris les doses normales de Tropica et j'ai ajouté en plus des nitrates (KNO3). Dès que je vois des GSA apparaitre je baisse la dose de nitrates et... ca marche ! Pour le moment en tout cas, il me faudra plus de temps pour m'en assurer dans la durée.
Je n'ai pas nettoyé les vitres de mon aquarium depuis 2 mois et je n'ai aucune algue visible dessus. Quand j'en vois réapparaitre, je remonte un peu les nitrates et elles partent. Je navigue à vue comme cela et ça me convient.
Il me reste tout de même une algues qui je pense doit être de la cladophora (algue pinceau verte) dont je n'arrive pas à me débarrasser, ce n'est donc pas encore parfait. Elle ne prolifère plus quand les GSA sont là mais repart dès que je baisse les nitrates.
Pour le reste, mon bac fait 240 litres, est très planté (on ne voit plus le sol), j'éclaire avec des rampes led aquatlantis et chihiros (18000 lumens au total, 6h/jour). J'ai bien monté le CO2 il y a 2 semaines pour que mes plantes poussent mieux (l'alternanthera renickii mini était chétive et les feuilles basses se faisaient couvrir par la cladophora), je doit être à 4 bulles/sec sur le compte bulle de mon diffuseur JBL proflora direct (je pense pouvoir monter encore, peut-être que ça tuerait les algues restantes mais je n'ose pas pour l'instant faire son protocole d'étalonnage du CO2, j'ai peur pour mes poissons). Je change 20 L d'eau/semaine, je taille chaque semaine également et je nettoie le filtre tous les mois.
J'attends vos avis et retours maintenant .
.
Puis je suis passé à la fertilisation Tropica, que j'utilise toujours. Les choses se sont bien améliorer (cela a été un peu long au début mais je n'ai pas abandonné et je suis resté assidu). Cependant, quelque chose m'étonnait, les nitrates étaient bien montés d'après les tests (environ 20 ppm) et les phosphates étaient eux non détectables. J'ai au départ compensé les phosphates manquants en tentant d'augmenter la dose. Je me suis retrouvé avec des GSA, j'ai donc ajouté des phosphates (KH2PO4) les GSA ont disparues et... les autres algues sont revenues...
Et j'ai découvert cette méthode. Globalement content de la fertilisation Tropica, je ne voulais pas l'abandonner, j'ai donc "adapté" la méthode à ma manière : j'ai repris les doses normales de Tropica et j'ai ajouté en plus des nitrates (KNO3). Dès que je vois des GSA apparaitre je baisse la dose de nitrates et... ca marche ! Pour le moment en tout cas, il me faudra plus de temps pour m'en assurer dans la durée.
Je n'ai pas nettoyé les vitres de mon aquarium depuis 2 mois et je n'ai aucune algue visible dessus. Quand j'en vois réapparaitre, je remonte un peu les nitrates et elles partent. Je navigue à vue comme cela et ça me convient.
Il me reste tout de même une algues qui je pense doit être de la cladophora (algue pinceau verte) dont je n'arrive pas à me débarrasser, ce n'est donc pas encore parfait. Elle ne prolifère plus quand les GSA sont là mais repart dès que je baisse les nitrates.
Pour le reste, mon bac fait 240 litres, est très planté (on ne voit plus le sol), j'éclaire avec des rampes led aquatlantis et chihiros (18000 lumens au total, 6h/jour). J'ai bien monté le CO2 il y a 2 semaines pour que mes plantes poussent mieux (l'alternanthera renickii mini était chétive et les feuilles basses se faisaient couvrir par la cladophora), je doit être à 4 bulles/sec sur le compte bulle de mon diffuseur JBL proflora direct (je pense pouvoir monter encore, peut-être que ça tuerait les algues restantes mais je n'ose pas pour l'instant faire son protocole d'étalonnage du CO2, j'ai peur pour mes poissons). Je change 20 L d'eau/semaine, je taille chaque semaine également et je nettoie le filtre tous les mois.
J'attends vos avis et retours maintenant
 Cory29Membre : Accro
Cory29Membre : Accro
 Nombre de messages : 2408
Nombre de messages : 2408
Localisation : Finistère
Emploi : Retraité contrôle des populations (tueur à gages)
Date d'inscription : 18/05/2014
 Re: La méthode des déséquilibres controlés
Re: La méthode des déséquilibres controlés
Jeu 28 Déc 2017 - 18:43
Bravo pour cet argumentaire.
Je n'ai pas effectué d'expériences aussi poussées que toi. J'ai galéré pendant plus de 2 ans avec les algues dans mon 400L. J'ai "investi" dans un système CO2 et des rampes à leds il y a plus d'un an avec des résultats très positifs puisque les algues avaient disparu et les plantes poussaient rapidement. J'ai toutefois abandonné le CO2 au bout de 3 mois car je me suis rendu compte que c'était un énorme gâchis financier et écologique. Toutes les 3 semaines je jetais une bouteille vide mais neuve à la benne et çà me faisait mal au coeur. Et les algues sont revenues... Mon taux de nitrates affichant une valeur de 20 à 30 mg/l, je décidais d'introduire des Salvinias natans. En quelques semaines la surface en était recouverte. Le taux de nitrates n'a pas sensiblement baissé, ni les phosphates, mais les algues ont commencé à disparaitre. J'ai compris que çà ne venait pas des Salvinias elles-mêmes mais de l'ombre qu'elles provoquaient. J'ai donc débranché une demi-rampe sur chacune de mes 2 rampes et je maintiens les 3/4 de ma surface couverte par les Salvinias. J'ai également pu constater que le taux de fer était insuffisant et que le Profito ne palliait pas à cette carence.
Pour conclure, j'ai aujourd'hui un bac dépourvu d'algues, des plantes basiques qui poussent très bien (pas de gazonnantes), des poissons moins agressés par la lumière qui évoluent plus près de la surface et apprécient les zones d'ombre, une consommation en éclairage divisée par deux, je n'utilise plus de CO2, je fertilise très peu, bref j'ai un bac quasi comparable à celui qui me demandait des technologies sophistiquées et onéreuses, tout en faisant des économies. A réfléchir on consacre beaucoup plus de temps, d'argent et d'énergie avec les plantes qu'avec les poissons. Pourtant c'est bien pour les poissons à l'origine que l'on conçoit un bac.
Je n'apporte rien de scientifique mais j'ai enfin réussi à trouver un équilibre profitable à tout le monde et c'est du gagnant-gagnant.
Je n'ai pas effectué d'expériences aussi poussées que toi. J'ai galéré pendant plus de 2 ans avec les algues dans mon 400L. J'ai "investi" dans un système CO2 et des rampes à leds il y a plus d'un an avec des résultats très positifs puisque les algues avaient disparu et les plantes poussaient rapidement. J'ai toutefois abandonné le CO2 au bout de 3 mois car je me suis rendu compte que c'était un énorme gâchis financier et écologique. Toutes les 3 semaines je jetais une bouteille vide mais neuve à la benne et çà me faisait mal au coeur. Et les algues sont revenues... Mon taux de nitrates affichant une valeur de 20 à 30 mg/l, je décidais d'introduire des Salvinias natans. En quelques semaines la surface en était recouverte. Le taux de nitrates n'a pas sensiblement baissé, ni les phosphates, mais les algues ont commencé à disparaitre. J'ai compris que çà ne venait pas des Salvinias elles-mêmes mais de l'ombre qu'elles provoquaient. J'ai donc débranché une demi-rampe sur chacune de mes 2 rampes et je maintiens les 3/4 de ma surface couverte par les Salvinias. J'ai également pu constater que le taux de fer était insuffisant et que le Profito ne palliait pas à cette carence.
Pour conclure, j'ai aujourd'hui un bac dépourvu d'algues, des plantes basiques qui poussent très bien (pas de gazonnantes), des poissons moins agressés par la lumière qui évoluent plus près de la surface et apprécient les zones d'ombre, une consommation en éclairage divisée par deux, je n'utilise plus de CO2, je fertilise très peu, bref j'ai un bac quasi comparable à celui qui me demandait des technologies sophistiquées et onéreuses, tout en faisant des économies. A réfléchir on consacre beaucoup plus de temps, d'argent et d'énergie avec les plantes qu'avec les poissons. Pourtant c'est bien pour les poissons à l'origine que l'on conçoit un bac.
Je n'apporte rien de scientifique mais j'ai enfin réussi à trouver un équilibre profitable à tout le monde et c'est du gagnant-gagnant.
 alexv95Spécialiste plantes
alexv95Spécialiste plantes
 Nombre de messages : 3171
Nombre de messages : 3171
Localisation : Val d'Oise
Emploi : Jardinier aquatique
Date d'inscription : 10/11/2012
 Re: La méthode des déséquilibres controlés
Re: La méthode des déséquilibres controlés
Lun 1 Jan 2018 - 14:29
Très bonne année 2018 à toutes et tous  . Pour bien commencer l'année, j'ai terminé la rédaction du chapitre sur les algues, la traduction est donc terminée !
. Pour bien commencer l'année, j'ai terminé la rédaction du chapitre sur les algues, la traduction est donc terminée !
Merci pour ton retour Cory. On est d'accord que la méthode présentée ici est adaptée pour les bacs "high tech" (qui permets une plantation dense, avec des plantes "difficiles") mais qu'il existe également des méthodes moins couteuses (en temps et argent) pour les bacs "low tech".
Merci pour ton retour Cory. On est d'accord que la méthode présentée ici est adaptée pour les bacs "high tech" (qui permets une plantation dense, avec des plantes "difficiles") mais qu'il existe également des méthodes moins couteuses (en temps et argent) pour les bacs "low tech".
 Yann vialleMembre : Accro
Yann vialleMembre : Accro
 Nombre de messages : 2146
Nombre de messages : 2146
Localisation : Valence
Emploi : Chimiste
Date d'inscription : 07/09/2017
 Re: La méthode des déséquilibres controlés
Re: La méthode des déséquilibres controlés
Lun 1 Jan 2018 - 18:33
L'approche est à réfléchir.
Mais pas sur que ça me soit utile aujourd'hui.
J'ai des ciano, mais 0 PO4.
Mais pas sur que ça me soit utile aujourd'hui.
J'ai des ciano, mais 0 PO4.
_________________
Instagram : https://www.instagram.com/planted__life/
 alexv95Spécialiste plantes
alexv95Spécialiste plantes
 Nombre de messages : 3171
Nombre de messages : 3171
Localisation : Val d'Oise
Emploi : Jardinier aquatique
Date d'inscription : 10/11/2012
 Re: La méthode des déséquilibres controlés
Re: La méthode des déséquilibres controlés
Mar 2 Jan 2018 - 17:59
C'était mon cas aussi, mais il faudrait voir si c'est 0 de PO4 mesurés par les tests, c'est à dire non détectable mais peut-être tout de même présents à faible concentration. La méthode dit qu'il faut atteindre l'apparition de GSA pour éliminer l'algue et même à ce stade les PO4 doivent tout de même être présents en très faible quantité.
Dans mon cas, j'ai ajouté des nitrates (même si d'après les tests j'en avais suffisamment) et la cyano a régressé. J'en avais peu et c'était très localisé (entre la vitre et ma HCC), probablement dans une zone où les nitrates étaient rapidement consommés et où le brassage était trop faible pour en apporter suffisamment (c'est une hypothèse).
Dans mon cas, j'ai ajouté des nitrates (même si d'après les tests j'en avais suffisamment) et la cyano a régressé. J'en avais peu et c'était très localisé (entre la vitre et ma HCC), probablement dans une zone où les nitrates étaient rapidement consommés et où le brassage était trop faible pour en apporter suffisamment (c'est une hypothèse).
 Yann vialleMembre : Accro
Yann vialleMembre : Accro
 Nombre de messages : 2146
Nombre de messages : 2146
Localisation : Valence
Emploi : Chimiste
Date d'inscription : 07/09/2017
 Re: La méthode des déséquilibres controlés
Re: La méthode des déséquilibres controlés
Mar 2 Jan 2018 - 20:15
Je vais faire mon chiant. Mais j'ai et des GSA et des ciano.
Après la certitude du test. J'ai un doute. Effectivement.
Mais d'après l'article c'est contradictoire.
Après la certitude du test. J'ai un doute. Effectivement.
Mais d'après l'article c'est contradictoire.
_________________
Instagram : https://www.instagram.com/planted__life/
 alexv95Spécialiste plantes
alexv95Spécialiste plantes
 Nombre de messages : 3171
Nombre de messages : 3171
Localisation : Val d'Oise
Emploi : Jardinier aquatique
Date d'inscription : 10/11/2012
 Re: La méthode des déséquilibres controlés
Re: La méthode des déséquilibres controlés
Ven 5 Jan 2018 - 18:21
Ah c'est bizarre ça, elles sont juste présentes ou elles prolifèrent en même temps? Elles sont au même endroit dans le bac? Je pense que passer à un état favorable à la prolifération des GSA empêche le développement des autres algues mais n'élimine pas les algues déjà présentes (c'est pour que cela que pour certaines d'entre elle l'auteur recommande d'utiliser du glutaraldehyde pour éliminer les algues restantes en plus du protocole KNO3).
 Yann vialleMembre : Accro
Yann vialleMembre : Accro
 Nombre de messages : 2146
Nombre de messages : 2146
Localisation : Valence
Emploi : Chimiste
Date d'inscription : 07/09/2017
 Re: La méthode des déséquilibres controlés
Re: La méthode des déséquilibres controlés
Ven 5 Jan 2018 - 20:22
Elles avaient tendance à proliférer surtout au même endroit.
Avait car j'ai changer un petit truc. L'éclairage. Je suis passé de 46 lumen litre à 94 lm/L, et c'est radical, les plantes ont doublé de taille et la cyano à disparu (presque il reste les gros bout que j'ai pas enlevé).
J'ai au passage fait un petit ajout de PO4 pour les GSA histoire d'essayer. Pour le moment elles stagnent, je vais augmenter un peu pour voir ce que ça donne.
Par ce que certaine GSA sont très ''fleuri'' comme dit le monsieur. Ça ressemble presque au algues pinceau noir qu'on peut voir des fois mais en vert.
En tout cas entre mes 3 plus beaux bacs (en terme de pousse des plantes et non des types de plantes, ça serait trop subjectif), c'est qu'on peut lire partout qu'un éclairage fort c'est 45lm/L, alors que des qu'on dépasse les 70 tous devient magique.
Avait car j'ai changer un petit truc. L'éclairage. Je suis passé de 46 lumen litre à 94 lm/L, et c'est radical, les plantes ont doublé de taille et la cyano à disparu (presque il reste les gros bout que j'ai pas enlevé).
J'ai au passage fait un petit ajout de PO4 pour les GSA histoire d'essayer. Pour le moment elles stagnent, je vais augmenter un peu pour voir ce que ça donne.
Par ce que certaine GSA sont très ''fleuri'' comme dit le monsieur. Ça ressemble presque au algues pinceau noir qu'on peut voir des fois mais en vert.
En tout cas entre mes 3 plus beaux bacs (en terme de pousse des plantes et non des types de plantes, ça serait trop subjectif), c'est qu'on peut lire partout qu'un éclairage fort c'est 45lm/L, alors que des qu'on dépasse les 70 tous devient magique.
_________________
Instagram : https://www.instagram.com/planted__life/
 Yann vialleMembre : Accro
Yann vialleMembre : Accro
 Nombre de messages : 2146
Nombre de messages : 2146
Localisation : Valence
Emploi : Chimiste
Date d'inscription : 07/09/2017
 Re: La méthode des déséquilibres controlés
Re: La méthode des déséquilibres controlés
Sam 6 Jan 2018 - 20:20
Photo des GSA ''fleuries''.


_________________
Instagram : https://www.instagram.com/planted__life/
 alexv95Spécialiste plantes
alexv95Spécialiste plantes
 Nombre de messages : 3171
Nombre de messages : 3171
Localisation : Val d'Oise
Emploi : Jardinier aquatique
Date d'inscription : 10/11/2012
 Re: La méthode des déséquilibres controlés
Re: La méthode des déséquilibres controlés
Lun 15 Jan 2018 - 8:53
Effectivement c'est bizarre cette algue en petite touffe verte je n'en n'ai jamais vu. Tu sais ce que c'est ? Tu penses que c'est la GSA qui "fleurit"?
Tes plantes poussent bien sinon? Il faut que je retourne sur ton poste normalement j'ai les alertes mais j'ai l'impression qu'elles se sont désactivées.
Tes plantes poussent bien sinon? Il faut que je retourne sur ton poste normalement j'ai les alertes mais j'ai l'impression qu'elles se sont désactivées.
Page 1 sur 2 • 1, 2 

Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum

